Alternativer Treibstoff für fadenförmige Zell-Motoren
Molekularer Zwei-Komponenten-Motor nutzt eine Art erneuerbarer chemischer Energie.
Zellen haben die faszinierende Eigenschaft, ihr Inneres mit Hilfe winziger Proteinmaschinen, also molekularer Motoren, die gerichtete Bewegungen erzeugen, zu organisieren. Die meisten von ihnen nutzen dabei eine Art chemische Energie namens ATP als Treibstoff. Jetzt haben Forscher des MPI für molekulare Zellbiologie und Genetik, des Exzellenzclusters Physik des Lebens, des Biotechnologiezentrums der TU Dresden und des National Centre for Biological Sciences in Indien ein neuartiges molekulares System entdeckt, das eine alternative chemische Energie nutzt und einen neuartigen Mechanismus einsetzt, um mechanische Arbeit zu verrichten. Durch wiederholtes Zusammenziehen und Ausdehnen funktioniert dieser molekulare Motor ähnlich wie ein klassischer Stirlingmotor und hilft bei der Verteilung von Fracht an membrangebundene Organellen. Es ist der erste Motor, der zwei Komponenten verwendet, zwei Proteine unterschiedlicher Größe, Rab5 und EEA1, und der von GTP anstelle von ATP angetrieben wird.
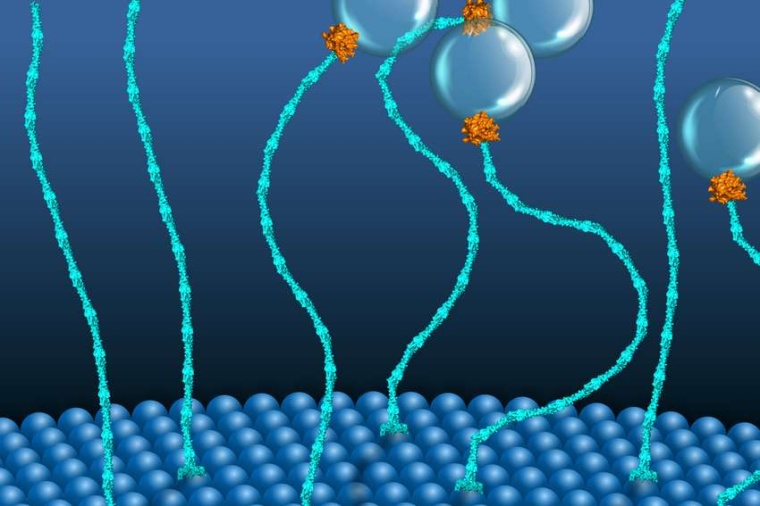
Motorproteine sind bemerkenswerte molekulare Maschinen im Inneren der Zelle. Sie wandeln chemische Energie, die in einem Molekül namens ATP gespeichert ist, in mechanische Arbeit um. Das bekannteste Beispiel ist Myosin, das unsere Muskeln bewegt. GTPasen hingegen galten bisher nicht als molekulare Krafterzeuger. Ein Beispiel ist ein molekularer Motor, der aus zwei Proteinen, EEA1 und Rab5, besteht. Im Jahr 2016 entdeckte ein Team, dass das kleine GTPase-Protein Rab5 eine Kontraktion in EEA1 auslösen kann. Diese fadenförmigen Tetherproteine können das Rab5-Protein in der Vesikelmembran erkennen und an sich binden. Die Bindung des viel kleineren Rab5 sendet eine Botschaft entlang der langgestreckten Struktur von EEA1 und macht dieses flexibel. Diese Flexibilität erzeugt eine Kraft, die das Vesikel zur Zielmembran zieht, wo es andockt und fusioniert. Außerdem schlug das Team vor, dass EEA1 nur durch die Interaktion mit Rab5 zwischen einem starren und einem flexiblen Zustand hin- und herschalten könnte, ähnlich wie bei einer mechanischen Motorbewegung.
Ziel der aktuellen Studie war es, diesen Motor experimentell in Aktion zu beobachten. Diese Experimente erforderten jedoch spezifische Modifikationen des Proteins, um dessen Flexibilität anhand seiner strukturellen Veränderungen messen zu können. Mit der Charakterisierung des EEA1-Proteins sollte die Frage beantworten werden, ob EEA1 und Rab5 einen Zwei-Komponenten-Motor bilden, wie von den Forschern vermutet. Die Schwierigkeiten, die richtigen Moleküle zu erhalten, konnten gelöst werden, indem man das EEA1-Protein so modifiziert, dass Fluorophore an bestimmte Proteinregionen binden können. Diese Modifikation erleichterte es, die Struktur des Proteins und die Veränderungen, die bei der Interaktion mit Rab5 auftreten können, zu charakterisieren.
Mit den geeigneten Proteinmolekülen konnten die Wissenschaftler die Dynamik von EEA1 mit den hochentwickelten Laser-Scanning-Mikroskopen der Lichtmikroskopie-Einrichtung am MPI-CBG und am NCBS genau charakterisieren. Erstaunlicherweise entdeckten sie, dass das EEA1-Protein mehrere Male den Übergang von starr zu flexibel und wieder zurück durchlaufen kann, angetrieben allein durch die chemische Energie, die bei seiner Interaktion mit der GTPase Rab5 freigesetzt wird. Diese Experimente zeigten, dass EEA1 und Rab5 einen GTP-gesteuerten Zwei-Komponenten-Motor bilden.
Um die Ergebnisse zu interpretieren, entwickelte das Team ein neues physikalisches Modell, das die Kopplung zwischen chemischen und mechanischen Schritten im Motorzyklus beschreibt. Außerdem gelang es den Forschern, auch die thermodynamische Effizienz des neuen Motorsystems berechnen, die mit der konventioneller ATP-getriebener Motorproteine vergleichbar ist. Die Ergebnisse zeigen, dass die Proteine EEA1 und Rab5 als molekulares Zwei-Komponenten-Motorsystem zusammenarbeiten, das chemische Energie in mechanische Arbeit umwandeln kann. Dadurch können sie eine aktive mechanische Rolle beim Membrantransport spielen. Es ist möglich, dass der Mechanismus des molekularen Motors, der die Kraft erzeugt, auch bei anderen Molekülen konserviert ist und von verschiedenen anderen zellulären Kompartimenten genutzt wird.
Die meisten molekularen Motoren verwenden einen gängigen zellulären Treibstoff namens ATP. Die kleinen GTPasen verbrauchen einen anderen Treibstoff, GTP, und wurden bisher hauptsächlich als Signalmoleküle betrachtet. Dass sie auch ein molekulares System antreiben können, um Kräfte zu erzeugen und Dinge zu bewegen, wirft ein interessantes neues Licht auf diese reichlich vorhandenen Moleküle. Es handelt sich also um eine neue Klasse von molekularen Motoren: Der Motor bewegt sich nicht wie der Kinesin-Motor, der Fracht entlang der Mikrotubuli transportiert, sondern verrichtet seine Arbeit, indem er an seinem Platz bleibt.
Das von den Wissenschaftlern verwendete Modell orientiert sich an dem des klassischen Stirlingmotors. Während der traditionelle Stirling-Motor mechanische Arbeit durch Ausdehnung und Komprimierung von Gas erzeugt, verwendet der beschriebene Zweikomponenten-Motor Proteine als Arbeitsmaterial, wobei eine veränderte Proteinflexibilität zur Krafterzeugung führt. Dieser Mechanismus eröffnet neue Möglichkeiten für die Entwicklung synthetischer Proteinmotoren. Die Forscher hoffen, dass diese neue interdisziplinäre Studie sowohl in der molekularen Zellbiologie als auch in der Biophysik neue Forschungsansätze ermöglichen könnte.
TU Dresden / RK
Weitere Infos
- Originalveröffentlichung
A. Singh et al.: Two-component molecular motor driven by a GTPase cycle. Nat. Physics, online 4. Mai 2023; DOI: 10.1038/s41567-023-02009-3 - Exzellenzclusters Physik des Lebens, Technische Universität Dresden











