Auflösungsrekord in der Kryo-Elektronenmikroskopie
Bislang schärfste Bilder zeigen erstmals einzelne Atome in einer Proteinstruktur.
Eine entscheidende Auflösungsgrenze in der Kryo-Elektronenmikroskopie ist geknackt: Holger Stark und sein Team am MPI für biophysikalische Chemie haben zum ersten Mal einzelne Atome in einer Proteinstruktur beobachtet und die bisher schärfsten Bilder mit dieser Methode aufgenommen. Mit solch detaillierten Einblicken lässt sich besser verstehen, wie Proteine in der lebenden Zelle ihre Arbeit verrichten oder Krankheiten hervorrufen. Auch kann die Technik zukünftig eingesetzt werden, um Wirkstoffe für neue Medikamente zu entwickeln.
Seit Ausbruch der COVID-19-Pandemie ermitteln Wissenschaftler weltweit die Strukturen wichtiger Schlüsselproteine des SARS-CoV-2-Virus in 3D. Ihr gemeinsames Ziel ist es, Andockstellen für einen Wirkstoff zu finden, mit dem der Erreger wirksam bekämpft werden kann. Möglich macht dies unter anderem die Kryo-Elektronenmikroskopie, mit der sich dreidimensionale Strukturen von Biomolekülen sichtbar machen lassen. Eine große Herausforderung, denn diese sind in ihrer Struktur äußerst flexibel. Um die wuseligen Moleküle einzufangen, ohne sie zu beschädigen, werden diese extrem schnell abgekühlt. Die tiefgefrorenen Proben werden mit Elektronen beschossen und die resultierenden Bilder aufgenommen. Aus den Aufnahmen kann dann die dreidimensionale Struktur der Moleküle berechnet werden.
Starks Gruppe erreichte nun einen entscheidenden Auflösungsrekord mit einem bisher einzigartigen Kryo-Elektronenmikroskop, das das Team neu entwickelt hat. „Unser Mikroskop besitzt zwei zusätzliche optische Elemente, mit denen wir die Bildqualität und Auflösung weiter verbessern konnten. Diese sorgen dafür, dass Abbildungsfehler optischer Linsen keine Rolle mehr spielen“, erklärt Stark.
Mehr als eine Million Bilder des Proteins Apoferritin hat das Forscherteam mit dem neuen Mikroskop aufgenommen, um die Molekülstruktur mit einer Auflösung von 0,125 Nanometern abzubilden. „Damit werden einzelne Atome im Protein sichtbar – ein Meilenstein auf unserem Gebiet“, erklärt Stark. Die neue Struktur enthüllt nie zuvor gesehene Details. „Selbst an das Apoferritin gebundene Wassermoleküle und Dichten für die Wasserstoff-Atome können wir sehen,“ so der Forscher.
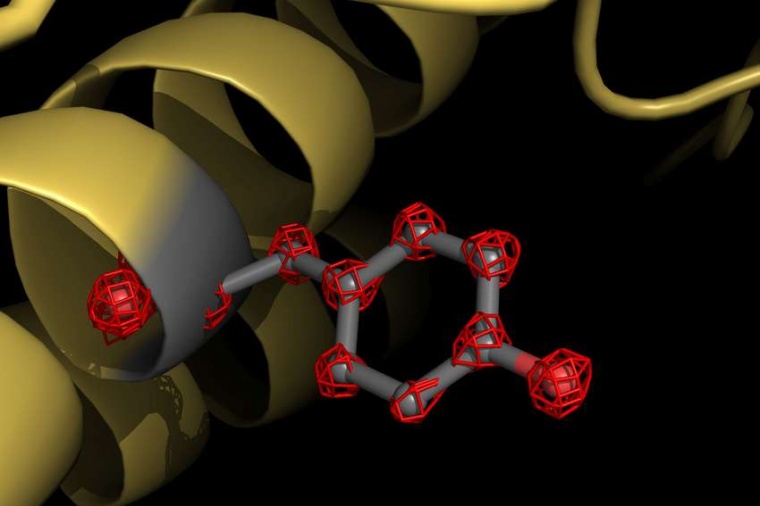
Doch welchen Nutzen hat es, eine Proteinstruktur derart hochaufgelöst untersuchen zu können? Will man die Funktionsweise von Proteinen entschlüsseln, muss man die exakte Lage aller ihrer Atome kennen. Solche detaillierten Einsichten sind auch eine wichtige Grundlage für das strukturbasierte Medikamentendesign. Wirkstoffmoleküle für Medikamente werden dafür so maßgeschneidert, dass sie beispielsweise an Virus-Proteine binden und diese in ihrer Funktion blockieren.
Doch welcher Mechanismus liegt der Hemmung zugrunde? Dieser lässt sich nur aufklären und verstehen, wenn die Wechselwirkung zwischen Wirkstoff und Virus-Protein auf atomarer Ebene beobachtet werden kann. Die so gewonnenen Erkenntnisse tragen dazu bei, Wirkstoffmoleküle für Medikamente zu verbessern und Nebenwirkungen zu reduzieren. „Mit dem jetzigen Schritt der Auflösungsverbesserung hat die Kryo-Elektronenmikroskopie ein Niveau erreicht, auf dem der Nutzen für pharmazeutische Entwicklungen direkt sichtbar wird“, so Stark.
MPIBPC, RK
Weitere Infos
- Originalveröffentlichung
K. M. Yip et al.: Atomic-resolution protein structure determination by cryo-EM, Nature, online 21. Oktober 2020; DOI: 10.1038/s41586-020-2833-4 - Abt. Strukturelle Dynamik (H. Stark), Max-Planck-Institut für biophysikalische Chemie, Göttingen













