Ein Käfig für Seltenerdmetalle
Seltenerdmetall-Hydrate lassen sich selektiv in Wirtsmoleküle einschließen.
Metalle der Seltenen Erden sind unabdingbar für viele technische Produkte, von Smartphones, Notebooks über Akkus, Elektromotoren und Windräder bis zu Katalysatoren. Ein japanisches Team stellt nun einen molekularen „Käfig“ mit „Deckeln“ vor, mit sich bestimmte Seltenerdmetall-Ionen selektiv gewinnen oder recyclen lassen.
Zu den Seltenen Erden zählen 17 Metalle: Scandium, Yttrium, Lanthan und die Lanthanoide, das heißt die 14 Elemente, die im Periodensystem auf Lanthan folgen, wie Neodym und Europium. Ihr Name ist etwas irreführend, denn die Seltenerdmetalle sind nicht wirklich selten. Sie kommen in der Umwelt überall vor, aber fein verteilt und in Mineralien („Erden“) gebunden, große Lagerstätten sind selten. Die Rückgewinnung aus Elektroschrott gewinnt an Bedeutung.
Inzwischen wurden Mikroorganismen entdeckt, die Enzyme mit Seltenerdmetallen enthalten. Sie könnten bei der (Rück-)Gewinnung helfen und liefern Anregungen für die Verwendung der Seltenerdmetalle als Katalysatoren. Auch in Gewässern und Abwässern finden sich Ionen der Seltenerdmetalle. Aus wässrigen Lösungen können sie jedoch nur schwer einzeln abgetrennt werden, unter anderem weil sie üblicherweise hydratisiert vorliegen, also Wassermoleküle fest gebunden haben. Ihre Hydratationszustände unterscheiden sich und können variabel sein. Dies erschwert und stört die Erkennung und Isolierung der Ionen durch Bindung an Liganden.
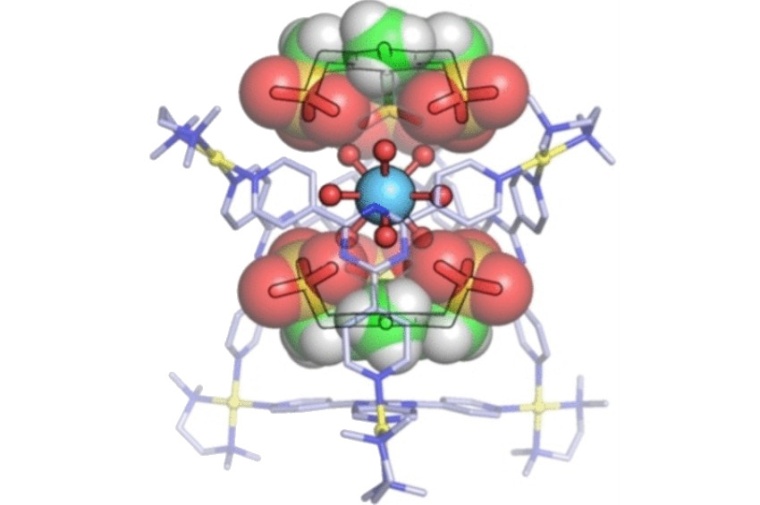
Dem Team um Makoto Fujita von der Universität Tokio und dem Institute for Molecular Science ist es jetzt gelungen, dreiwertige Ionen einer Reihe von Seltenerdmetallen in hydratisierter Form in geschlossenen „Käfigen“ einzufangen. Ein Käfigmolekül bestehen aus vier organischen Liganden in der Form dreieckiger „Platten“, deren Spitzen über sechs Palladium-Ionen miteinander zu einem oktaederförmigen Käfig mit zwei großen Öffnungen verknüpft sind. Das Seltenerdmetall-Ion findet mitsamt seinen neun gebundenen Wassermolekülen Platz im Käfig. Der entscheidende Kniff sind zwei „Deckel“, die die Öffnungen des Käfigs verschließen. Es handelt sich um planare Moleküle mit drei negativ geladenen Bindungsarmen, die über Wasserstoffbrücken an die Wassermoleküle der Seltenerdmetall-Ionen binden. Zusätzlich werden sie über elektrostatische Wechselwirkungen von den positiv geladenen Palladium-Ionen des Käfigs festgehalten.
Nicht alle Seltenerdmetall-Ionen werden gleich gut eingefangen. So bestimmen kleine Unterschiede der Radien und bevorzugten Hydratationsmodi, wie gut diese in die Käfige passen: Lanthan und die leichten Lanthanoide, wie Europium, werden wesentlich stärker gebunden als die schweren Lanthanoide, wie Ytterbium. Scandium etwa, das nur sechs Wassermoleküle koordiniert, kann sich im Käfig nicht stabil arrangieren und wird kaum gebunden. Das Einschließen hydrophiler Metall-Spezies in einen abgeschlossenen Hohlraum könnte ein Ansatz zur Isolation von Seltenerdmetallen sein, aber auch für die Entwicklung neuartiger Katalysatoren, in Analogie zu metallhaltigen Enzymen (Metallozymen) von Mikroorganismen.
Angew. Chem. / DE











