Scharfer Blick auf biologische Nanomaschinen
Kryo-Elektronenmikroskopie offenbart Details von Zellorganellen.
Jedes System hat seine Müllabfuhr: Indem die Zellorganellen Peroxisomen im menschlichen Körper unter anderem toxische Substanzen und Fette abbauen, verhindern sie ernsthafte Erkrankungen. Die Proteingruppe „Pex“ hält die „Entgiftungseinheiten“ funktionstüchtig – eine Forschungsgruppe der Universität Münster um Christos Gatsogiannis konnte jetzt erstmals auf atomarer Ebene zeigen, wie diese hochkomplexen Prozesse ablaufen. Möglich wurde der Erfolg durch das neue High-Tech-Mikroskop der Universität.
„Wir können uns Peroxisomen als Miniaturfabriken vorstellen, die sich auf verschiedene Aufgaben spezialisiert haben“, erklärt Christos Gatsogiannis. „In erster Linie sind sie für die Entgiftung der Zelle bekannt. Sie fungieren als zelluläre Abfallentsorgungseinheiten und bauen schädliche Substanzen ab, die sich sonst unter Umständen in unseren Zellen ansammeln.“ Das können etwa überschüssige Fettsäuren sein oder Giftstoffen aus unserer Umwelt; mindestens fünfzig verschiedene Prozesse dieser Art übernehmen die nur einen halben Mikrometer großen Zellorganellen.
Besonders systemrelevant ist die Rolle der Peroxisomen beim Fettstoffwechsel. Denn sie bauen Fette nicht nur ab, sie wandeln sie auch in verwertbare Energie um – die wiederum für verschiedene körperliche Prozesse unerlässlich ist. Ohne Peroxisomen können sich etwa gefährliche Mengen bestimmter Fette im Körper ansammeln; ernsthafte Gesundheitsprobleme wären die Folge. Altersbedingte Krankheiten werden daher häufig mit Störungen der Peroxisomalfunktion in Verbindung gebracht, zum Beispiel Hör- und Sehverlust, Alzheimer, Diabetes oder Krebs.
Jeder dieser Prozesse erfordert eine Reihe spezifischer Enzyme. Die Peroxisomen sind allerdings von einer biologischen Membran umgeben, die die Proteine nicht ohne weiteres passieren können – sie müssen importiert werden. Dieser Importmechanismus braucht Energie und eine weitere Gruppe von Proteinen, die Pex: „Ähnlich wie ein Lastwagen, der Produkte von einem Ort zum anderen transportiert, benötigt der Transport von Enzymen ein Transportprotein, Energie und eine gut durchdachte Logistik, um effizient zu sein“, zieht Doktorand Maximilian Rüttermann aus der Arbeitsgruppe einen Vergleich. „Und wie ein Lastwagen wird das Protein wiederverwendet oder recycelt, bis es schließlich zerfällt.“
Dieser Recycling-Mechanismus ist der einzige energieaufwendige Schritt des gesamten Importprozesses. Die Hauptrolle spielt dabei der peroxisomale AAA-ATPase-Komplex Pex1/Pex6: Die biologische Nanomaschine entpackt und entfaltet die verbrauchten Proteine, damit sie recycelt oder abgebaut werden können. AAA-ATPasen sind dabei grundsätzlich eine Art zelluläres Reinigungsteam, das die innere Umgebung der Zelle sauber, funktionell und bereit für die Anforderungen des Lebens hält. Wenig überraschend ist somit, dass die meisten Störungen der peroxisomalen Biogenese mit Mutationen in Pex1 oder Pex6 verbunden sind: Bis zu sechzig Prozent aller Fälle gehen dabei auf eine seltene genetische Störung zurück, bei der die Zellen der Patienten nicht in der Lage sind, Peroxisomen zu bilden. Der breiten Öffentlichkeit ist dies nicht bekannt, da die betroffenen Patienten in der Regel schon wenige Tage oder Wochen nach der Geburt sterben – bisher gibt es keine heilende Therapie.
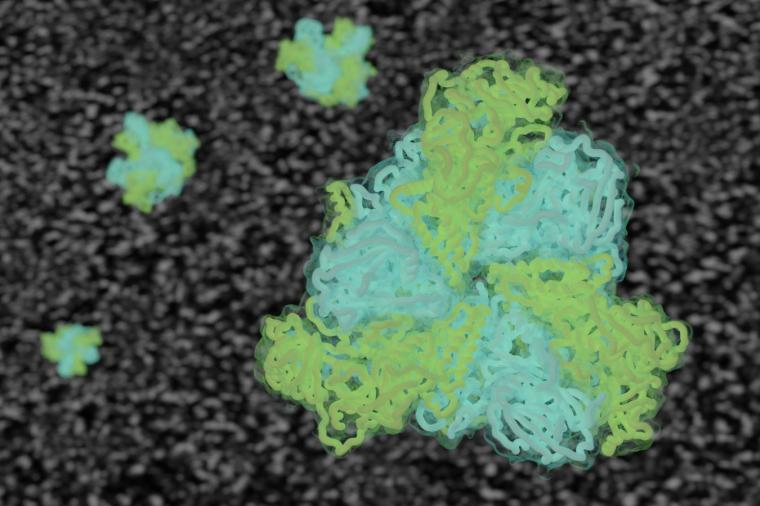
Die Forschungsgruppe hat nun erstmals im atomaren Detail gezeigt, wie die peroxisomale AAA-ATPase andere Enzyme prozessiert, um die Entgiftungseinheiten funktionsfähig zu halten. Dazu nutzten die Forschenden die Methode der kryo-Elektronenmikroskopie. „Die Untersuchung eines hochdynamischen Komplexes wie der AAA-ATPase Pex1 Pex6 ist wie die Beobachtung eines laufenden Automotors“, veranschaulicht Maximilian Rüttermann. „Man macht Millionen von Bildern aus allen Blickwinkeln, während er im Betrieb ist und erstellt auf dieser Grundlage ein dreidimensionales Modell in all seinen verschiedenen Zuständen.“ Die Gruppe hat im Frühjahr ein hoch modernes Kryo-Elektronenmikroskop in Betrieb genommen: Die 7,5 Millionen Euro teure Neuanschaffung ermöglicht, Proteine und biologische Nanomaschinen auf atomarer Ebene zu untersuchen und so die Geheimnisse der Zellfunktion zu entschlüsseln.
Die hoch-aufgelösten Strukturen zeigen, wie die Proteine Pex1 und Pex6 synchron zusammenarbeiten: Sie ziehen ein Substrat ähnlich den verwendeten Import-Rezeptoren aus der Membran, um deren Recycling zu ermöglichen – ein einzigartiger Mechanismus, vergleichbar mit einer Reihe von Armen, die ein dickes Seil schrittweise in Paare ziehen und dabei seine Knoten lösen. „Die atomaren Strukturen und das Verständnis für den Mechanismus dieser komplexen Nanomaschine erlaubt uns nun, wichtige Schritte der Peroxisom-Physiologie in Gesundheit und Krankheit zu verstehen“, resümiert Christos Gatsogiannis. „Nun ist es auch möglich, alle bekannten Mutationen mit ihrer Funktion in Verbindung zu bringen, um ihre chemischen Folgen und damit die Ursachen von Stoffwechselstörungen zu verstehen.“
U. Münster / JOL













