Zugvögel mit Quantenkompass
Das Eiweiß Cryptochrom 4 ist vermutlich der seit langem gesuchte Magnetsensor.
Während Menschen die Welt mit fünf Sinnen – Sehen, Hören, Schmecken, Riechen und Tasten – wahrnehmen, orientieren sich viele Tiere auch am Erdmagnetfeld. Schon seit längerem hat ein interdisziplinäres Team der Universitäten Oldenburg und Oxford Hinweise dafür gesammelt, dass der Magnetsinn von Zugvögeln wie beispielsweise Rotkehlchen auf einem bestimmten lichtempfindlichen Eiweiß im Auge beruht. Nun zeigen die Forschenden, dass das Eiweiß Cryptochrom 4, das sich in der Netzhaut von Vögeln befindet, empfindlich auf Magnetfelder reagiert und somit höchstwahrscheinlich der gesuchte Magnetsensor ist.
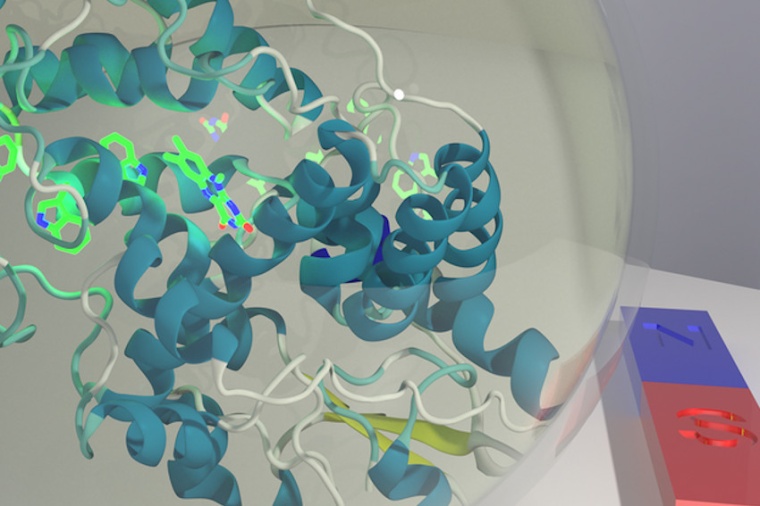
Ein entscheidender Schritt auf dem Weg zu diesem Erfolg gelang Jingjing Xu, Doktorandin in Henrik Mouritsens Arbeitsgruppe an der Universität Oldenburg. Nachdem der genetische Code des potentiell magnetisch sensitiven Cryptochroms 4 von Rotkehlchen entschlüsselt worden war, konnte Xu das Pigment erstmals mit Hilfe von Bakterienkulturen in großen Mengen produzieren. Die Gruppen von Christiane Timmel und Stuart Mackenzie in Oxford nutzten anschließend verschiedene Methoden, darunter Magnetresonanzmessungen und neue spektroskopische Verfahren, um das Eiweiß zu untersuchen und seine ausgeprägte Empfindlichkeit für Magnetfelder nachzuweisen.
Darüber hinaus entschlüsselte das Team auch den Mechanismus, durch den diese Sensitivität entsteht – ein weiterer wichtiger Fortschritt. „Eine entscheidende Rolle dabei spielen Elektronen, die sich innerhalb des Moleküls bewegen können, nachdem sie durch blaues Licht aktiviert wurden“, erläutert Mouritsen. Eiweiße wie Cryptochrom sind Ketten aus Aminosäuren. Das Cryptochrom 4 von Rotkehlchen besteht aus 527 dieser Bausteine. Chemiker um Peter Hore aus Oxford und der Oldenburger Physiker Ilia Solov’yov führten quantenmechanische Modellrechnungen durch, die nahelegen, dass vier der 527 Aminosäuren – Tryptophane – entscheidend für die magnetischen Eigenschaften des Moleküls sind. Den Berechnungen zufolge hüpfen Elektronen von einem Tryptophan zum nächsten und erzeugen dabei Radikalpaare, die magnetisch sensitiv sind. Um dies experimentell zu belegen, stellte das Team aus Oldenburg leicht veränderte Versionen des Cryptochroms von Rotkehlchen her, in denen sie jeweils ein Tryptophan durch eine andere Aminosäure ersetzen. Auf diese Weise blockierten sie die Bewegung von Elektronen.
Anhand dieser modifizierten Proteine konnten Chemiker aus Oxford experimentell zeigen, dass sich die Elektronen innerhalb des Cryptochroms genauso bewegen wie in den theoretischen Berechnungen vorhergesagt – und dass die erzeugten Radikalpaare entscheidend dafür sind, die beobachteten Magnetfeld-Effekte zu erklären. Das Oldenburger Team stellte darüber hinaus Cryptochrom 4 von Hühnern und Tauben her. Untersuchungen in Oxford zeigten, dass die Proteine dieser Arten, die nicht zu den Zugvögeln zählen, zwar ähnlich auf Licht reagieren wie das des Rotkehlchens, doch sie erwiesen sich als deutlich weniger empfindlich für Magnetfelder.
„Wir finden diese Ergebnisse sehr wichtig, weil sie zum ersten Mal zeigen, dass ein Molekül aus dem Sehapparat eines Zugvogels magnetisch sensitiv ist“, sagt Mouritsen. Ein endgültiger Nachweis, dass es sich bei Cryptochrom 4 um den gesuchten Magnetsensor handele, sei dies aber nicht. Denn bei allen Experimenten untersuchten die Forscher die Eiweiße isoliert im Labor. Die verwendeten Magnetfelder waren zudem stärker als das Erdmagnetfeld. „Was noch fehlt ist der Nachweis, dass dieser Prozess auch in den Augen von Vögeln stattfindet“, betont Mouritsen. Solche Studien seien derzeit allerdings technisch noch nicht möglich.
Die Autoren gehen aber davon aus, dass die Moleküle in ihrer natürlichen Umgebung deutlich empfindlicher für Magnetfelder sind. In Zellen der Netzhaut sind die Proteine wahrscheinlich fixiert und in die gleiche Richtung ausgerichtet, wodurch ihre Sensitivität für die Richtung des Magnetfeldes ansteigen sollte. Überdies interagieren sie in den Zellen mit anderen Proteinen, die vermutlich die Sinnesreize verstärken. Nach diesen bislang noch unbekannten Partnermolekülen sucht das Team derzeit. Der endgültige Nachweis von Cryptochrom 4 als Magnetsensor wäre Hore zufolge von grundlegender Bedeutung: „Wenn uns das gelingt, würden wir zeigen, dass dieser quantenphysikalische Mechanismus Tiere empfindlich für Umweltreize macht, die um sechs Größenordnungen unterhalb der Schwelle liegen, die bislang als wahrnehmbar galt“, so der Forscher.
U. Oldenburg / JOL











