Eine Tür in Zellinnere
Neues Modell für Lipid-Flöße in Zellmembranen stellt natürliche Bedingungen dar.
Wenn man durch eine Tür ins Haus gehen will, nimmt man am besten einen Schlüssel in die Hand, schließt auf und geht hinein. Wenn man aber keine Ahnung hat, wie der Schlüssel aussieht oder wo er versteckt ist – unter der Fußmatte, an der Kellertreppe? –, wird es jedoch bedeutend schwieriger. So ähnlich ist es auch in der Biologie. Dass es Türen gibt, die das Innere von Zellen mit dem Äußeren verbinden, ist selbstverständlich bekannt. Eine dieser Türen jedoch gibt den Wissenschaftlern nach wie vor Rätsel auf: Lipid Rafts, auf deutsch „Lipid-Flöße“. Dabei handelt es sich um bestimmte Bereiche in der Zellmembran, in denen sich vor allem Lipide ansammeln, die für die Signalübertragung von Zellen wichtig sind. Wie Flöße „schwimmen“ diese Bereiche durch die Zellmembran. Über Lipid Rafts können auch Moleküle in die Zelle hinein- und hinausgelangen.
Wissenschaftler vermuten, dass Lipid Rafts auch am Anfang von Krankheiten wie zum Beispiel Alzheimer, Parkinson oder Aids stehen, deren Erreger über Lipid Raft in die Zellen gelangen. Ein Verständnis dieses Mechanismus ist also von grundlegender Bedeutung für die Entstehung solcher Krankheiten.
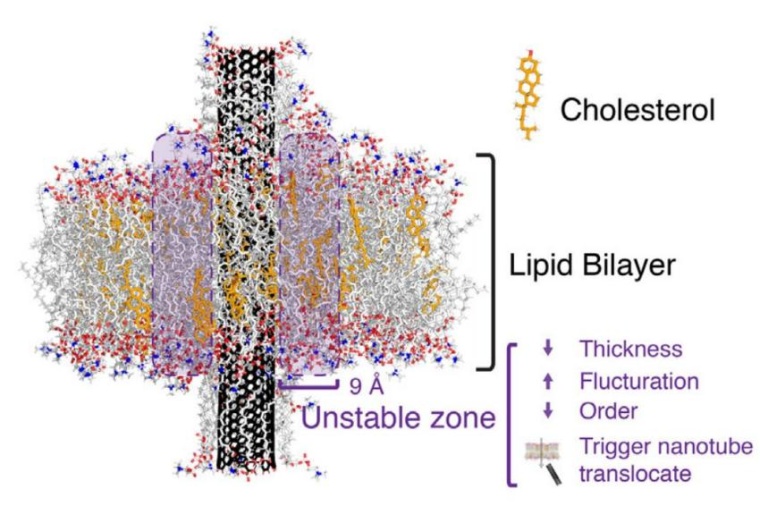
Die Crux an der Sache: Bisher konnte noch niemand Lipid Rafts in lebenden Zellen nachweisen. Lediglich in Modellmembranen sind die „Flöße“ bisher beobachtet worden. „Diese Modelle waren aber nicht sehr gut auf echte Zellen übertragbar“, erklärt Jean-Baptiste Fleury, der aktuell an seiner Habilitation arbeitet. Der Experte für Mikrofluidik, der am Lehrstuhl von Ralf Seemann als Experimentalphysiker forscht, erläutert, woran das liegt: „Zum einen waren bisherige Experimente sehr groß, nämlich im Mikrometer-Bereich. Auf Zellebene laufen die Vorgänge allerdings auf Nanometer-Ebene ab, also nochmals um Faktor tausend darunter. Zudem waren die Lipid Rafts im Experiment bisher viel kurzlebiger als in echten Zellen“, erklärt Fleury. Statt zwischen einer und 15 Millisekunden existierten die bisherigen Experimental-Lipid-Flöße nur für rund zehn Nanosekunden, also etwa dem Millionstel der natürlichen Lipid-Flöße.
Jean-Baptiste Fleury entwickelte nun ein Experiment, das sowohl die Größenskala, die zeitliche Dimension und auch die künstliche Membran deutlich näher an die natürlichen Gegebenheiten heranbringt als dies bisher der Fall ist. Dazu hat er rund zehn Nanometer lange Röhren als künstliches Protein auf eine künstliche Doppelmembran gegeben. Beobachten konnte er dabei, dass die Cholesterin-Konzentration eine entscheidende Rolle dafür spielt, ob die Nanoröhrchen durch die Zelle hindurchgelangten oder ob sie in der Zellmembran gefangen blieben. „Wir haben festgestellt, dass Nanoröhren bei hohen Cholesterinkonzentrationen innerhalb weniger Millisekunden spontan aus der Doppelschicht austreten können, während sie in der Membran eingeschlossen bleiben, wenn die Doppelschicht kein Cholesterin enthält.“
Die Grundlage dafür entwickelten theoretische Physiker der Universität Rovira i Virgili in Tarragona (Spanien) und der Nanjing Universität in China. In monatelangen Computersimulationen haben sie das Verhalten der Nanoröhrchen und des Cholesterins berechnet und anschließend die saarländische Expertise von Jean-Baptiste Fleury als Experimentalphysiker hinzugezogen, um die theoretischen Erkenntnisse im Experiment zu überprüfen. Auf diese Weise hat das internationale Forscherteam grundlegende neue Ansätze zur Erforschung der Lipid Raft gelegt, so dass womöglich auch die Entstehung von Krankheiten und die zellulären Abläufe besser verstanden werden können.
U. Saarland / DE
Weitere Infos
- Originalveröffentlichung
Y. Guo et al.: Unexpected Cholesterol-Induced Destabilization of Lipid Membranes near Transmembrane Carbon Nanotubes, Phys. Rev. Lett. 124, 038001 (2020); DOI: 10.1103/PhysRevLett.124.038001 - Transport Properties of Model Cell Membrane (J.-B. Fleury), Universität des Saarlandes













