Gefaltet oder nicht?
Fluoreszenzsonde zeigt Faltungszustand und Polarität von Proteinen an.
Stress bringt Zellen aus dem Gleichgewicht. Ihre Proteinsynthese und die Maschinerie zur korrekten Faltung von Proteinen werden gestört. Fehlgefaltete Proteine kommen nicht an ihren Wirkungsort und werden wieder abgebaut. Dadurch sammeln sich im Zytoplasma inaktive Proteine und Abbauprodukte an, die sich auch bei neurodegenerativen Erkrankungen und Krebs bemerkbar machen. Forscher nehmen an, dass die Polarität bei der Aggregation eine Rolle spielt. Yuning Hong und ihre Grupe von der La Trobe University Melbourne in Australien haben nun zusammen mit Kollegen eine bimodale fluorogene Sonde entwickelt, die den Zustand der Proteinaggregation anhand der Polarität anzeigt.
Ein Modus der Sonde ist das Erspüren fehlgefalteter Proteine. Korrekt gefaltete Proteine werden häufig durch interne Brücken aus der Aminosäure Cystein stabilisiert. Diese Brücken liegen zumeist tief im Inneren des Proteins. Bei fehlgefalteten und entfalteten Proteinen befinden sich die Cysteine außen. Wenn die Sonde an einem äußeren Cystein bindet, schaltet sich das Fluoreszenzsignal ein.
Der andere Modus ist die Erfassung der Polarität. Eine polare Umgebung bedeutet eine unausgewogene elektronische Verteilung, die als Dielektrizitätskonstante gemessen werden kann. Um diesen Parameter zu messen, fügten die Forscher der fluorogenen Sonde eine chemische „Push–Pull“-Gruppe hinzu. Durch die Erspürung des elektronischen Drucks oder Zugs verschob sich das Fluoreszenzsignal in polaren Lösungen mit hoher Dielektrizitätskonstante. Wie ein Chamäleon änderte die Sonde ihre Farbe.
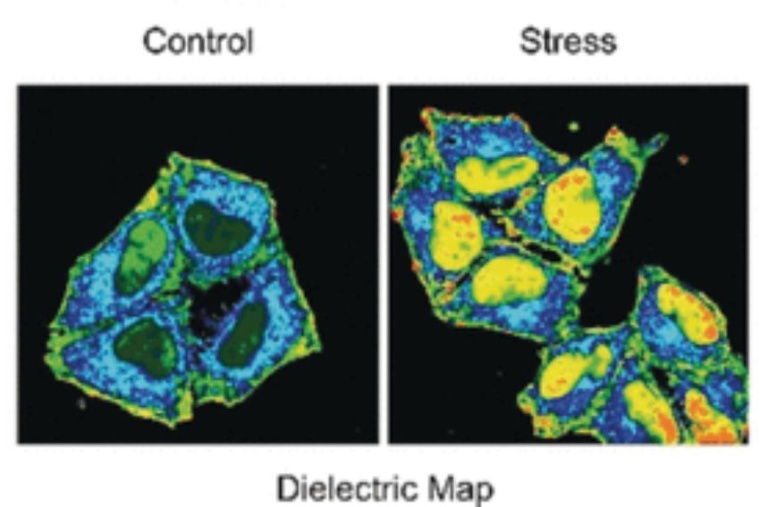
Die Autoren testeten die NTPAN-MI-Sonde an einer menschlichen Zelllinie, die durch Wirkstoffe in ihrer Proteinsynthese beeinträchtigt war. Unbehandelte Zellen zeigen normale, gleichmäßige Fluoreszenz. Zellen, die mit Toxinen oder Viren behandelt wurden, sammelten jedoch fehlgefaltete Proteine an, was sich als verstärkte Fluoreszenz bemerkbar machte. Darüber hinaus signalisierte ein farbverschobenes Fluoreszenzsignal die Polarität der Umgebung und damit den Zustand des Proteoms, der Gesamtheit der Proteine. Laut Aussage der Autoren wurde somit zum ersten Mal der Anteil der ungefalteten oder fehlgefalteten Proteine im Zellkern sichtbar gemacht. Bislang konnte man nur entfaltete Proteine im Zytoplasma erfassen.
Mit ihren beiden Sensormoden – Messung des Entfaltungszustands und der Polarität – liefert die NTPAN-MI-Sonde ein schärferes Bild über die Stressreaktion von Zellen, als es mit monomodalen Sonden oder mit anderen Methoden bislang möglich war. Die Autoren glauben, dass die neue Technik dazu beitragen könnte, besser zu verstehen, wie die Stressantwort in den Zellkompartimenten aussieht und wie diese miteinander kommunizieren.
Wiley-VCH / DE













