Hochdruck-Spektroskopie enträtselt Proteinstruktur
Dreitausend Bar sind für einen umfassenden Blick auf ein Protein nötig.
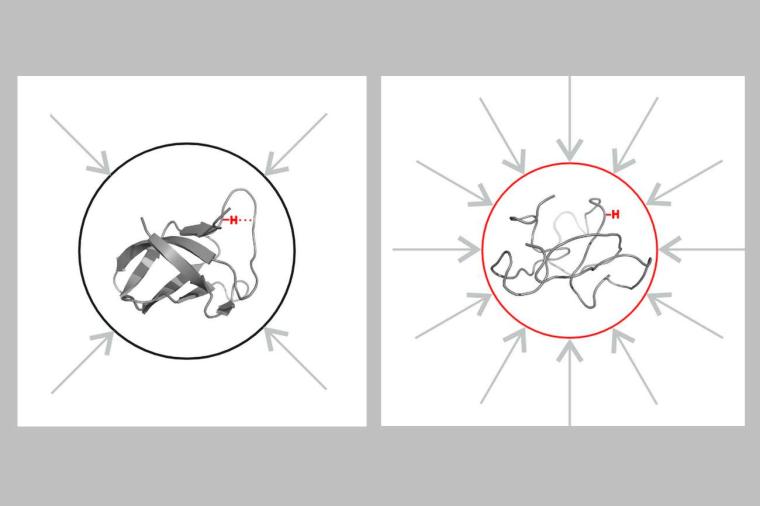
Ein Druck von dreitausend Bar liegt auf dem Kälteschockprotein B des Bacillus subtilis, in einem kleinen Röhrchen im NMR-Spektroskopie-Labor der Uni Konstanz. Das entspricht in etwa dem Dreifachen des Wasserdrucks am tiefsten Punkt der irdischen Ozeane. Der Druck ist so intensiv, dass das hochdynamische Protein strukturelle Merkmale zeigt, die unter Normaldruck nicht deutlich genug ausgeprägt sind. Warum aber wenden die Wissenschaftler diesen hohen Druck an, wie er sonst nirgendwo auf unserem Planeten unter natürlichen Bedingungen vorkommt? Die Antwort lautet: Um Prozesse und Eigenschaften zu untersuchen, die zu flüchtig sind, um sie unter Normalbedingungen überhaupt beobachten zu können.
„Durch den Hochdruck machen wir Zustände sichtbar, die es bei einem Bar zwar schon gibt, die aber erst bei dreitausend Bar direkt beobachtbar sind“, schildert Frederic Berner von der Uni Konstanz. Er erforscht im wahrsten Sinne des Wortes „unter Hochdruck“ die Eigenschaften, die einem Protein durch seine Struktur gegeben sind – und wie Änderungen in der Struktur dessen Eigenschaften beeinflussen. Gemeinsam mit Michael Kovermann, Leiter der Arbeitsgruppe „Magnetische Resonanzspektroskopie komplexer molekularer Systeme“, entwickelte er eine neue Methode, wie die strukturellen Eigenschaften eines Proteins möglichst unverfälscht von Umgebungseffekten analysiert werden können – bei dreitausend Bar.
Proteine sind Grundbausteine des Lebens. Sie bestehen aus Aminosäureketten, deren dreidimensionale Struktur die unterschiedlichsten Formationen annehmen kann: Sie falten sich, wie man auch ein langes Papierband in die unterschiedlichsten Formen knicken kann. Die funktionalen Eigenschaften eines Proteins hängen dabei wesentlich von der Art seiner Faltung ab. Dasselbe Protein kann also unterschiedliche Wirkungen in der Zelle haben, je nachdem, in welche Form es gefaltet ist. „Was für Proteine wichtig ist, ist ihre Struktur, die wiederum mit Funktionen verbunden ist. Wenn man biochemische Mechanismen aufklären will, benötigt man Informationen über ihre Struktur“, so Berner.
In der Forschung möchte man die Eigenschaften der Proteinstruktur idealerweise in ihrer reinen Form festhalten – möglichst ungetrübt von Einflussfaktoren aus ihrer Umgebung. Das ist aber gar nicht so einfach, aus zwei Gründen: Erstens gibt es so gut wie immer Wechselwirkungen mit dem Lösungsmittel, in dem das Protein liegt, sowie mit benachbarten Abschnitten seiner Molekülkette. Zweitens sind Proteine hochdynamisch, ihre Faltung ist immerzu in Bewegung. Es gibt zum Beispiel Proteine, die unentwegt wie eine Schere auseinander- und wieder zusammenklappen. In den Bruchteilen einer Sekunde, in denen es aufklappt, findet eine chemische Reaktion statt. Das geschieht allerdings viel zu schnell, um es direkt untersuchen zu können.
Hier kommt nun der Druck von dreitausend Bar ins Spiel: Das Molekül wird dadurch in einen bestimmten Zustand gedrückt und damit strukturell manipuliert: Die Schere bleibt aufgeklappt. Nun erst können die Forscher in Ruhe mittels Kernspinresonanzspektroskopie spezifische strukturelle Eigenschaften des Proteins untersuchen, die unter Normaldruck nicht direkt zugänglich sind.
Bisherige Analyseverfahren nehmen die Umgebungseffekte häufig in Kauf und versuchen, sie hinterher herauszurechnen. Das neue Hochdruckverfahren von Kovermann und Berner kann die Umgebungseffekte hingegen von vornherein unterdrücken oder korrigieren, um einen möglichst unverfälschten Blick auf das Protein zu haben. Besonders aufschlussreich ist es, das neue Verfahren in Kombination mit bestehenden Methoden zu verwenden und zu vergleichen, da auf diese Weise die unterschiedlichen Einflussfaktoren im Detail sichtbar werden. Das Hochdruckverfahren hat bereits jetzt, in der frühen Phase seiner Anwendung, sehr gute Ergebnisse erzielt. Berner und Kovermann betonen, dass nun weitere Experimente und Computersimulationen stattfinden sollen, um das Verfahren weiter zu überprüfen und potenziell zu verfeinern.
U. Konstanz / RK
Weitere Infos
- Originalveröffentlichung
F. Berner & M. Kovermann: Including the Ensemble of Unstructured Conformations in the Analysis of Protein's Native State by High-Pressure NMR Spectroscopy, Ang. Ch. Int. Ed. 2024, e202401343 (2024); DOI: 10.1002/anie.202401343 - Magnetische Resonanzspektroskopie komplexer molekularer Systeme (M. Kovermann), Universität Konstanz











