Membranfusion unter der Lupe
Erste Schritte des biologisch fundamentalen Prozesses per biophysikalischer Simulation untersucht.
Biologische Membranen sind äußerst komplex: Sie bestehen nicht nur aus tausenden verschiedenen Lipid-Arten, sondern sind überdies asymmetrisch aufgebaut. Welchen biologischen Vorteil die hohe Komplexität haben könnte, wollen Saarbrücker Physiker um Jochen Hub herausfinden. Mithilfe einer neue Computer-Simulationsmethode haben sie Membranfusionen untersucht, die bei vielen biologischen Funktionen eine zentrale Rolle spielen. Die Ergebnisse könnten erste mögliche Erklärungen liefern.
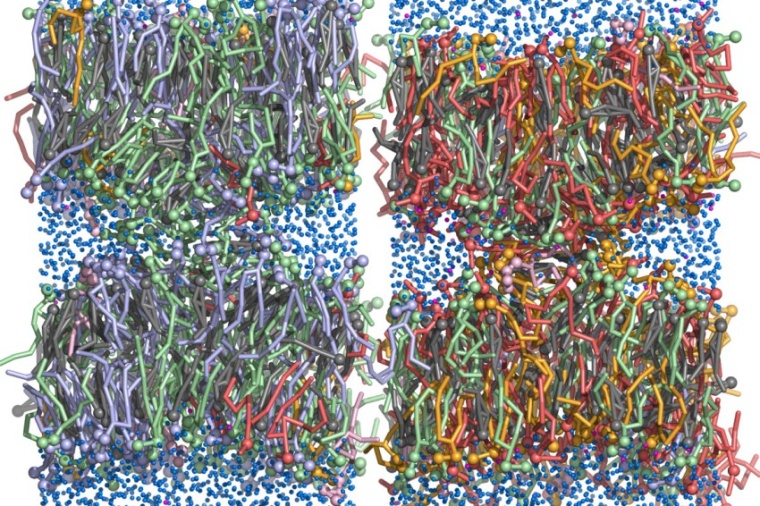
Biologische Membranen sind aus tausenden verschiedenen Lipid-Arten zusammengesetzt, zudem sind sie asymmetrisch: Sie bestehen aus einer inneren Lipidschicht und einer äußeren Lipidschicht, die sich stark unterscheiden. Warum Zellen diesen Aufwand betreiben, um eine solche Komplexität zu synthetisieren und zu erhalten, ist bisher nicht bekannt.
Bei vielen biologischen Prozessen verschmelzen zwei Membranen miteinander. Diese Membranfusionen laufen beispielsweise ab, wenn Viren mit ihrer Wirtszelle verschmelzen, oder bei der Signalweiterleitung an Synapsen. Bei der Erforschung dieses komplexen Geschehens haben sich Jochen Hub und sein Team zunächst auf den ersten Schritt der Membranfusion fokussiert: die Bildung eines „Stalks“, bei dem die beiden fusionierenden Membranen eine lokale Verbindung eingehen.
Hierzu entwickelten die Forscher eine neue Computer-Simulationsmethode, welche die Stalk-Bildung im Vergleich zu vorherigen Modellen viel effizienter und zugleich quantitativ nachbilden kann. „Dabei haben wir herausgefunden, dass die innere Einzelschicht typischer Plasmamembranen – das sind Membranen, die die Zelle umgeben – viel fusionsfreudiger ist als die äußere Einzelschicht“, erläutert der Professor für theoretische Physik.
Für den biologischen Vorteil der Asymmetrie gibt es aus seiner Sicht folgende mögliche Erklärung: „Eine effiziente Fusion mit der inneren Schicht – und damit meinen wir eine schnelle Fusion mit geringem Energieaufwand – ist im Interesse der Zellen, beispielsweise, damit synaptische Signale schnell weitergeleitet werden können. Synaptische Vesikel fusionieren nämlich zunächst mit der inneren Einzelschicht der Plasmamembran“, erklärt Jochen Hub. Dagegen könnte eine erschwerte Fusion mit der äußeren Einzelschicht ein Schutz der Zelle gegen virale Infektionen sein, da Viren zunächst mit der äußeren Einzelschicht fusionieren. „Diese Erklärung ist bisher reine Hypothese, allerdings verstehen wir nun zum ersten Mal quantitativ und auf molekularer Ebene, wie die Fusion von Membranen von deren komplexen Lipidzusammensetzung gesteuert wird.
Dank der Effizienz ihrer Simulationsmethode konnten Hub und sein Team Stalk-Bildung unter rund 200 verschiedenen Bedingungen mit verschiedenen Lipidzusammensetzungen simulieren und somit bestimmen, welche Bestandteile der inneren Einzelschicht diese im Vergleich zur äußeren Einzelschicht so viel fusionsfreudiger machen.
U. Saarland / DE













