Vom Kreislauf des Stickstoffs
Ungewöhnlich gestapelte Enzyme erzeugen wichtige Stickstoff-Verbindung.
Wissenschaftler dreier Max-Planck-Institute (MPI), des MPI für medizinische Forschung in Heidelberg, des MPI für Marine Mikrobiologie in Bremen und des MPI für Biophysik in Frankfurt und der Radboud Universität in Nimwegen ist es gelungen, die Struktur des Enzyms zu bestimmen, das einen großen Teil des Nitrats auf der Erde produziert. Mikroorganismen nutzen dieses Enzym, genannt NXR oder Nitrit-Oxidoreduktase, um giftiges Nitrit in Nitrat umzuwandeln. Sowohl Nitrit als auch Nitrat sind Formen von Stickstoff, die einen großen Einfluss auf unsere Umwelt haben.
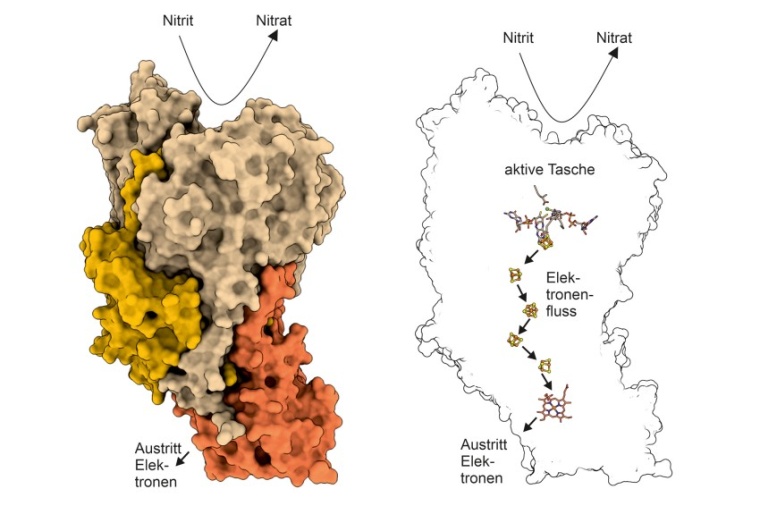
Nitrat ist ein Nährstoff und für viele biologische Prozesse, zum Beispiel für das Wachstum der Pflanzen, ein wichtiges Molekül, das auf der Erde in großen Mengen (rund 600 Milliarden Tonnen) vorkommt. Nahezu das gesamte in der Natur vorkommende Nitrat wird dabei durch die Oxidation von Nitrit durch die Nitrit-Oxidoreduktase (NXR) hergestellt. NXR ist somit ein entscheidendes Enzym im globalen biologischen Stickstoffkreislauf. Es kommt zum einen in nitritoxidierenden Bakterien (NOB, einschließlich Comammox-Organismen) vor, die den Großteil des Nitrats in der Umwelt erzeugen, zum anderen in anaeroben ammoniumoxidierenden (Anammox) Bakterien. Anammox-Bakterien produzieren etwa die Hälfte des Distickstoffgases in unserer Atmosphäre. Die beteiligten Wissenschaftler konnten nun die Struktur des Enzyms NXR aus Anammox-Bakterien aufklären.
Die Ergebnisse zeigen im Detail, wie NXR aufgebaut ist: Die einzelnen NXR-Einheiten stapeln sich wie Rückenwirbel turmartig übereinander, eine bisher nicht beobachtete Struktur. „Kryo-Elektronentomographie und helikale Rekonstruktion haben gezeigt, dass NXR diese ungewöhnliche tubuläre Strukturen, wie lange Fasern, in den Anammox-Zellen ausbildet“, so Kristian Parey vom Max-Planck-Institut für Biophysik. Ihre Funktion ist derzeit jedoch noch unklar. Eindeutiger ist die Struktur der einzelnen NXR-Moleküle: Auf einer Seite gibt es eine sogenannte „aktive Tasche“, in der Nitrit gebunden und in Nitrat umgewandelt wird. Dabei werden Elektronen freigesetzt und über eine Art elektrische Leitung zur anderen Seite des Moleküls transportiert. Dort können diese Elektronen von anderen Molekülen abgegriffen werden und für den Zellstoffwechsel genutzt werden. „NXR wird wegen seiner Bedeutung für den globalen Stickstoffkreislauf schon seit Jahrzehnten untersucht, aber wie NXR-Moleküle genau aussehen, wussten wir nicht“, sagt Thomas Barends, Gruppenleiter am MPI für medizinische Forschung in Heidelberg. „Jetzt kennen wir die detaillierte Struktur dieser Moleküle, was hilft, die Funktionsweise von NXR zu verstehen.“
„Bei Anammox-Bakterien war die Verbindung zwischen Nitrit-Oxidation und Nitrit-Reduktion bisher rätselhaft“, ergänzt Boran Kartal, Gruppenleiter am MPI für Marine Mikrobiologie in Bremen. „Diese Studie bringt uns einen großen Schritt weiter um zu verstehen, wie diese Mikroorganismen die Energieproduktion und Wachstum verbinden.“ Der Anammox-Prozess ist ein besonders spannender Teil des Stickstoff-Kreislaufs: Durch diesen Prozess werden Nitrit oder Stickoxid und Ammonium direkt in molekularen Stickstoff umgewandelt, der immerhin 78 Prozent unserer Atmosphäre ausmacht. „Unsere detaillierte Untersuchung des molekularen Mechanismus der Nitritoxidation wird uns helfen, die Faktoren aufzudecken, die die Nitratproduktion in der Natur steuern, die ein wichtiger Schritt im ökologischen Nährstoffkreislauf ist“, so Kartal weiter.
„Aufgrund der großen Umweltbelastung durch Nitrit und Nitrat ist es wichtig zu wissen, wie Bakterien mit diesen Substanzen umgehen, um von den Prozessen zu lernen“, betont auch Barends. Wegen ihrer Eigenschaften werden Anammox-Bakterien zunehmend zur Reinigung von Abwässern in Klärwerken eingesetzt. Die Funktionsweise besser zu verstehen, könnte zu einem effizienteren Einsatz führen.
MPG / DE
Weitere Infos
- Originalveröffentlichung
T. Moreno Chicano et al.: Structural and functional characterization of the intracellular filament-forming nitrite oxidoreductase multiprotein complex, Nat. Microbiol. 6, 1129 (2021); DOI: 10.1038/s41564-021-00934-8 - Strukturbiologie (W. Kühlbrand), Max-Planck-Institut für Biophysik, Frankfurt am Main













