Wie Bakterien auf Oberflächen haften
Physikalische Erklärung des Haftmechanismus kann bei der Verbesserung antibakterieller Oberflächen helfen.
In Krankenhäusern sind multiresistente Bakterien eine ständige Bedrohung. Dort können sie zum Beispiel Türgriffe und Lichtschalter besiedeln und auf Implantaten zu schweren Infektionen führen. Ein Physikerteam der Universität des Saarlandes hat jetzt gezeigt, warum die Krankenhauskeime besonders gut an Materialien haften, von denen Wasser abperlt und besonders schlecht an Oberflächen, die von Wasser benetzt werden. Diese Forschungsergebnisse aus der experimentellen und theoretischen Physik können helfen, antibakterielle Oberflächen zu verbessern.
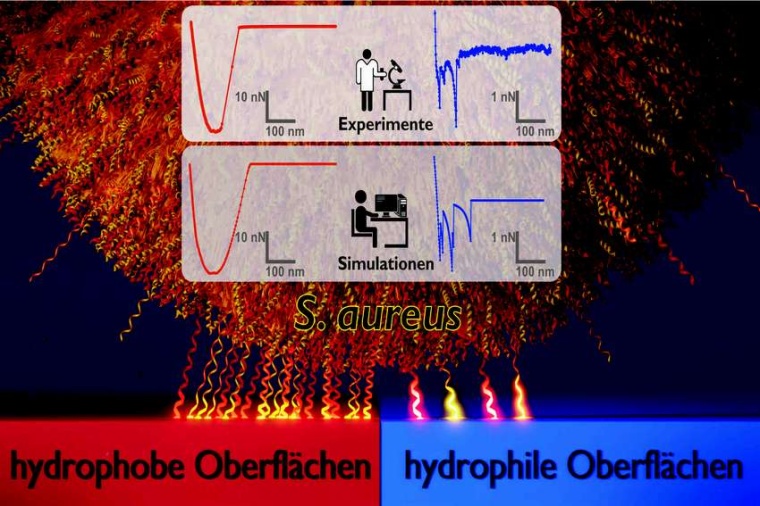
Bakterien der Art Staphylococcus aureus sind eine der häufigsten Ursachen für Infektionen, die Patienten während eines Krankenhausaufenthalts bekommen. Die Erreger werden besonders gefürchtet, weil sie auf natürlichen und künstlichen Oberflächen robuste Biofilme bilden können, die nur schwer zu entfernen sind. „Die einzelnen Bakterien sind in diesen Biofilmen selbst gut geschützt vor Antibiotika und der menschlichen Immunabwehr. Daher ist es so gefährlich, wenn sie sich zum Beispiel auf Implantaten ansiedeln und nach einer Operation dort Infektionen verursachen“, erläutert Experimentalphysikerin Karin Jacobs von der Universität des Saarlandes. Wichtig sei es daher, die Bildung von Biofilmen von vornherein zu verhindern.
Dazu müssen die Forscher aber zuerst die Mechanismen verstehen, mit denen Bakterien an verschiedenen Materialien haften. Mit Hilfe eines Rasterkraftmikroskops drückten die Wissenschaftler die winzigen Bakterienzellen auf verschiedene Oberflächen und bestimmten dabei die Kraft, die erforderlich war, um die Zellen wieder abzulösen. Bei den Experimenten wurden Kraft-Distanz-Kurven aufgenommen. „Als Modelloberflächen haben wir extrem glatte Siliziumoberflächen verwendet, die einmal so präpariert wurden, dass sie gut von Wasser benetzt werden und einmal so, dass sie wasserabweisend sind. Dabei stellte sich heraus, dass die Zellen auf hydrophoben Oberflächen deutlich stärker haften als auf hydrophilen“, erklärt Jacobs. Aber nicht nur die Haftkräfte, sondern auch die Formen der Kraft-Distanz-Kurven unterscheiden sich grundlegend zwischen den beiden Oberflächen. Hydrophobe Oberflächen liefern sehr glatte Kurven mit charakteristischer Tassen-Form, hydrophile Oberflächen dagegen zeigen individuelle Kurvenformen mit zahlreichen Zacken.
Um diese experimentellen Ergebnisse zu verstehen, wurden in der Theoriegruppe von Ludger Santen Monte-Carlo-Simulationen durchgeführt, mit deren Hilfe die Dynamik komplexer Systeme modelliert werden kann. Das Modell beschreibt das Bakterium als starre Kugel und die Zellwandmoleküle an der Oberfläche als kleine Federchen. „Für die richtige Beschreibung der Experimente ist es entscheidender, die Zufallskomponente bei der Bindung an der Oberfläche zu betrachten, als die Komplexität des theoretischen Modells zu erhöhen. Wir haben dabei herausgefunden, warum sich die Bakterien je nach Oberfläche so unterschiedlich verhalten: Auf wasserabweisenden Materialien haften sehr viele Zellwandmoleküle, was insgesamt zu einer starken Haftung und einer gleichmäßig glatten Form der Kraft-Distanz-Kurven führt“, erläutert Santen. Auf den hydrophilen Oberflächen hingegen blieben nur wenige Moleküle hängen, die Zelle haftete folglich schlechter und die Kurvenform wurde weniger gleichmäßig. Die gezackte Kurvenform wird verursacht durch wenige, einzelne Zellwandmoleküle, die sich einzeln von der Oberfläche ablösen. Dadurch können die Bakterien als Ganzes schlechter an der hydrophilen Materialoberfläche anhaften.
Als Grund für die unterschiedliche Anzahl haftender Zellwandmoleküle konnten die Physiker verschiedene Wechselwirkungen und eine damit verbundene Potenzialbarriere identifizieren. „Während die Potenzialbarriere auf hydrophilen Oberflächen vergleichsweise hoch ist und nur von wenigen Molekülen in einer bestimmten Zeit überwunden werden kann, ist sie auf hydrophoben Oberflächen vernachlässigbar klein, sodass sehr viele Moleküle unmittelbar anhaften können“, erklärt Team-Mitglied Christian Spengler, der für die Experimente der Studie verantwortlich war.
UdS / RK
Weitere Infos
- Originalveröffentlichung
E. Maikranz et al.: Different binding mechanisms of Staphylococcus aureus to hydrophobic and hydrophilic surfaces, Nanoscale, online 16. September 2020; DOI: 10.1039/d0nr03134h - Zentrum für Biophysik, Universität des Saarlandes, Saarbrücken













