Zellen kommunizieren in Wellen
Neues Modell offenbart komplexe mechanisch-chemische Wechselwirkungen.
Physikalische Berechnungen helfen, komplexe biologische Phänomene bis ins kleinste Detail zu verstehen. Edouard Hannezo vom Institute of Science and Technology Austria (ISTA) erkundet damit beispielsweise physikalische Prinzipien in biologischen Systemen. Die aktuellste Studie seiner Gruppe liefert nun neue Erkenntnisse darüber, wie sich Zellen im lebenden Gewebe bewegen und kommunizieren.
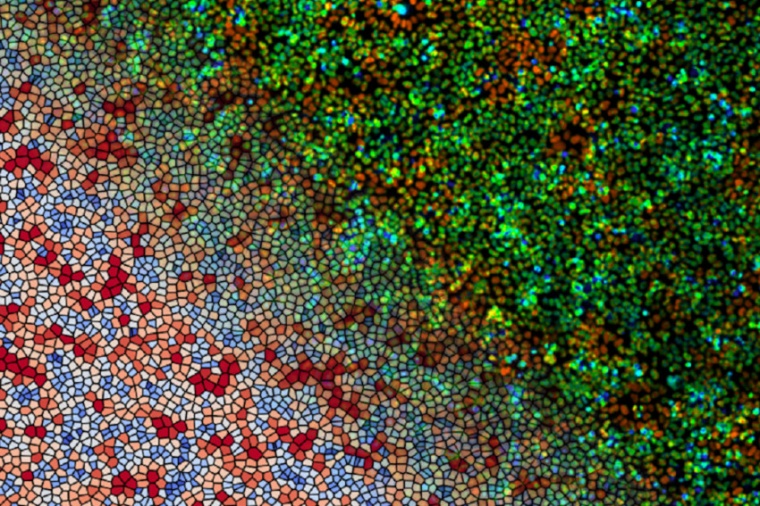
Während seiner Dissertation entwickelte Daniel Boocock zusammen mit Hannezo und Tsuyoshi Hirashima von der National University of Singapore ein detailliertes neues theoretisches Modell der Zell-Zell-Kommunikation. Es beschreibt sowohl die komplexen mechanischen Kräfte, die die Zellen aufeinander ausüben, als auch ihre biochemische Aktivität. „Nehmen wir an, man hat eine Petrischale, die mit Zellen bedeckt ist – ein einschichtiger Zellrasen oder kurz Monolayer. Es wirkt so, als würden die Zellen einfach nur dasitzen. Tatsächlich aber bewegen sie sich, sie wirbeln herum und zeigen spontan chaotische Verhaltensweisen“, erklärt Hannezo.
Ähnlich wie ein dichtes Gedränge auf einem Konzert reagieren Zellen darauf, wenn eine andere Zelle an einer Seite anzieht. Entweder folgen sie in die gleiche Richtung oder schieben in die entgegengesetzte an. Informationen breiten sich somit in Wellen aus, die sogar unter dem Mikroskop sichtbar sind. „Zellen nehmen nicht nur mechanische Kräfte wahr, sondern auch ihre chemische Umgebung, also jene Kräfte und biochemische Signale, die die Zellen aufeinander ausüben“, so Hannezo weiter. „Ihre Kommunikation ist ein Zusammenspiel aus biochemischer Aktivität, physikalischem Verhalten und Bewegung; das Ausmaß der einzelnen Kommunikationsarten und die Art und Weise, wie solche mechanisch-chemischen Wechselwirkungen in lebenden Geweben funktionieren, war bisher jedoch schwer zu erfassen.“
Angetrieben von den Wellenbildern war es das Ziel der Wissenschafter, ein theoretisches Folgemodell zu entwickeln, das ihre bisherige Theorie über die Bewegung von Zellen von einer Region zur nächsten bestätigt. Daniel Boocock erklärt: „In unserer früheren Arbeit wollten wir den biophysikalischen Ursprung der Wellen aufdecken und herausfinden, ob sie eine Rolle bei der Organisation der kollektiven Zellwanderung spielen. Allerdings hatten wir weder den Flüssig-Fest-Übergang des Gewebes, das systemeigene Rauschen noch die detaillierte Struktur der Wellen in 2D berücksichtigt.“ Ihr neuestes Computermodell beachtet Zellbeweglichkeit und Materialeigenschaften des Gewebes. Damit fanden Boocock und Hannezo heraus, wie Zellen mechanisch und chemisch kommunizieren und wie sie sich bewegen. Die in Petrischalen beobachteten Phänomene konnten sie replizieren und damit eine theoretische Erklärung der Zellkommunikation auf Basis physikalischer Gesetze verifizieren.
Für den experimentellen Nachweis dieses rein theoretischen Modells arbeiteten die beiden mit dem Biophysiker Tsuyoshi Hirashima zusammen. Zur Überprüfung, ob das neue Modell auf echte biologische Systeme angewandt werden kann, verwendeten die Wissenschafter 2D-Monolayer von MDCK-Zellen – spezifische Säugetiernierenzellen, die ein klassisches In-vitro-Modell für solcherlei Forschung sind.„Blockierten wir einen chemischen Signalweg, der Zellen das Spüren und Erzeugen von Kräften ermöglicht, bewegten sich die Zellen nicht mehr und es breiten sich keine Kommunikationswellen mehr aus“, erklärt Hannezo. „Mit unserer Theorie können wir verschiedene Komponenten des komplexen Systems verändern und einfach feststellen, wie sich die Dynamik des Gewebes verändert.“
Zellgewebe ähnelt in gewisser Weise Flüssigkristallen: Es fließt wie eine Flüssigkeit, ist aber kristallartig angeordnet. Boocock erklärt: „Insbesondere das flüssigkristall-ähnliche Verhalten von biologischem Gewebe wurde bisher nur unabhängig von mechanisch-chemischen Wellen untersucht.“ Eine Ausweitung auf 3D-Gewebe oder Monolayer mit komplexen Formen, wie sie in lebenden Organismen vorkommen, ist ein potentieller nächster Forschungsansatz. Ebenso haben die Forschenden begonnen, das Modell in Hinsicht auf Wundheilung zu optimieren. Wo Parameter den Informationsfluss verbessern, wurde Heilung beschleunigt – in Simulationen. Hannezo fügt begeistert hinzu: „Richtig interessant wird sein, inwieweit sich unser Modell bei der Wundheilung in Zellen innerhalb von lebenden Organismen bewährt.“
ISTA / JOL
Weitere Infos
- Originalveröffentlichung
D. Boocock et al.: Interplay between Mechanochemical Patterning and Glassy Dynamics in Cellular Monolayers, PRX Life 1, 013001 (2023); DOI: 10.1103/PRXLife.1.013001 - Physikalische Prinzipien in biologischen Systemen, Institute of Science and Technology Austria (ISTA), Klosterneuburg











