Dem Ursprung der Chiralität auf der Spur
Wechselspiel elektrischer und magnetischer Feldern könnte die Händigkeit von Biomolekülen erklären.
Biomoleküle wie Aminosäuren und Zucker kommen in zwei spiegelbildlichen Formen vor – in lebenden Organismen findet man hingegen immer nur eine. Warum dem so ist, ist nach wie vor unklar. Nun haben Forscher der Empa und des Forschungszentrums Jülich Hinweise dafür gefunden, dass das Wechselspiel zwischen elektrischen und magnetischen Feldern am Ursprung dieses Phänomens stehen könnte.
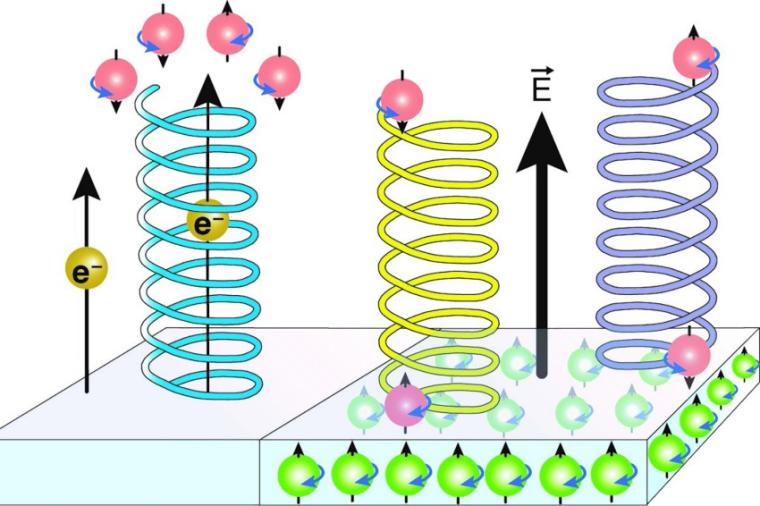
Über die Chiralität des Lebens – die Tatsache, dass alle Biomoleküle in lebenden Organismen nur in einer von zwei spiegelbildlichen Formen vorkommen – haben sich schon etliche Koryphäen den Kopf zerbrochen, angefangen mit dem Entdecker der molekularen Chiralität, Louis Pasteur, über William Thomson (Lord Kelvin) bis zum Nobelpreisträger Pierre Curie. Eine schlüssige Erklärung fehlt nach wie vor, sind doch beide Formen zum Beispiel chemisch gleich stabil und unterscheiden sich auch sonst in ihren chemisch-physikalischen Eigenschaften nicht voneinander. Schon früh kam indes die Hypothese auf, dass das Wechselspiel zwischen elektrischen und magnetischen Feldern die Vorliebe für die eine oder andere spiegelbildlichen Formen eines Moleküls – die Enantiomere – erklären könnte.
Doch erst vor einigen Jahren gab es erste indirekte Hinweise darauf, dass die verschiedensten Kombinationen dieser Kraftfelder in der Tat zwischen den beiden Spiegelbildern eines Moleküls unterscheiden können. Und zwar bei der Untersuchung der Wechselwirkung chiraler Moleküle mit metallischen Oberflächen, die auf kurzen Distanzen ein starkes elektrisches Feld aufweisen. Daher erlauben es die Oberflächen von magnetischen Metallen wie Eisen, Kobalt oder Nickel, elektrische und magnetische Felder unterschiedlich miteinander zu kombinieren – man kehrt einfach die Magnetisierungsrichtung um, von „Nord oben – Süd unten“ zu „Süd oben – Nord unten“. Sollte das Wechselspiel zwischen Magnetismus und elektrischen Feldern tatsächlich enantioselektive Effekte auslösen, dann sollte sich zum Beispiel auch die Stärke der Wechselwirkung zwischen chiralen Molekülen und magnetischen Oberflächen unterscheiden – je nachdem, ob sich ein rechtshändiges oder linkshändiges Molekül auf der Oberfläche absetzt.
Und dies ist in der Tat der Fall, wie der Empa-Forscher Karl-Heinz Ernst aus der Abteilung „Surface Science and Coating Technologies“ und Kollegen am Peter-Grünberg-Institut des Forschungszentrums Jülich in Deutschland kürzlich berichteten. Das Team hat eine (unmagnetische) Kupferoberfläche mit kleinen, ultradünnen Inseln aus magnetischem Kobalt bedampft und in diesen mittels Spin-polarisierter Rastertunnelmikroskopie die Richtung des magnetischen Feldes bestimmt; diese kann – wie oben erwähnt – in zwei unterschiedlichen, senkrecht zur Metalloberfläche verlaufenden Richtungen verlaufen: Nord oben oder Süd oben. Auf diese Kobaltinseln haben sie dann im Ultrahochvakuum sprialförmige chirale Moleküle – also eine Eins-zu-Eins-Mischung aus links- und rechthändigen Heptahelizenmolekülen – aufgebracht.
Dann haben sie – ebenfalls mittels Rastertunnelmikroskopie – die Anzahl rechts- beziehungsweise linkshändiger Helizenmoleküle auf den unterschiedlich magnetisierten Kobaltinseln gezählt, insgesamt knapp 800 Moleküle. Und siehe da: Je nach Richtung der Magnetisierung hatte sich bevorzugt die eine oder aber die andere Form der Helizenspiralen niedergelassen.
Außerdem zeigte sich in den Experimenten, dass die Selektion – die Vorliebe für die eine oder andere Helizenform – nicht erst beim Binden auf den Kobaltinseln stattfindet, sondern bereits vorher. Bevor die Moleküle ihren endgültigen, bevorzugten Platz auf einer der Kobaltinseln einnehmen, wandern sie nämlich in einem deutlich schwächer gebundenen Vorläuferzustand weite Strecken über die Oberfläche auf der Suche nach einem idealen Platz. Dabei sind sie lediglich durch Van-der-Waals-Kräfte an der Oberfläche gebunden. Diese werden durch Fluktuationen in der Elektronenhülle von Atomen und Molekülen verursacht, sind also relativ schwache Bindungskräfte. Dass selbst diese vom Magnetismus, also vom Spin der Elektronen, beeinflusst wird, war bislang nicht bekannt.
Mittels Rastertunnelmikroskopie konnten die Forscher zudem ein weiteres Rätsel aufklären, wie sie bereits im November berichteten. Auch der Elektronentransport – also der elektrische Strom – hängt von der Kombination von molekularer Händigkeit und Magnetisierung der Oberfläche ab. Je nach Händigkeit der gebundenen Moleküle fließen daher bevorzugt Elektronen mit einem Spin durch das Molekül, Elektronen mit dem falschen Spin werden also herausgefiltert. Diese als chiralitäts-induzierte Elektronenspin-Selektivität (CISS-Effekt) war bereits in früheren Studien beobachtet worden, doch blieb dabei unklar, ob dafür ein Ensemble von Molekülen notwendig ist oder ob auch einzelne Moleküle diesen Effekt zeigen. Ernst und seine Jülicher Kollegen konnten nun zeigen, dass auch einzelne Helizenmoleküle den CISS-Effekt zeigen. „Die Physik dahinter ist allerdings noch immer nicht verstanden“, gibt Ernst unumwunden zu.
Und auch die Frage nach der Chiralität des Lebens könnten seine Ergebnisse letztlich nicht vollständig beantworten, so Ernst. Die Frage also, die der Chemie-Nobelpreisträger und ETH-Chemiker Vladimir Prelog bereits 1975 in seiner Nobelpreisrede als „eines der ersten Probleme der molekularen Theologie“ bezeichnet hat. Doch der Empa-Forscher kann sich durchaus vorstellen, dass bei bestimmten Oberflächen-katalysierten chemischen Reaktionen – wie sie sich etwa in der chemischen Ursuppe abgespielt haben könnten – die Kombination von elektrischen und magnetischen Feldern zu einer stetigen Anreicherung der einen oder anderen Form der verschiedenen Biomoleküle geführt haben könnte – und somit letztlich zur Händigkeit des Lebens.
Empa / DE













