Der Dübel der Biophysik
Mechanische Stabilität einer wichtigen Molekül-Verbindung untersucht.
Mechanische Kräfte beeinflussen viele biologische Systeme, etwa wenn Muskelzellen kontrahieren und sich wieder ausdehnen. Auch bestimmte zelluläre Signalkaskaden – beispielsweise bei der Autoregulation von Gefäßen – werden durch mechanische Kräfte in Gang gesetzt. Um die molekularen Mechanismen solcher Prozesse zu untersuchen, analysieren Wissenschaftler das Verhalten von Biomolekülen unter mechanischem Stress. Biophysiker der Uni München um Hermann Gaub haben in Kooperation mit dem Physiker Rafael Bernardi von der University of Illinois in den USA jetzt ein wichtiges Werkzeug für solche Analysen detailliert untersucht und gezeigt: Die Geometrie des Werkzeugs wirkt sich auf dessen Stabilität aus und sollte für einen optimalen Einsatz berücksichtigt werden.
Wie Biomoleküle auf mechanische Kräfte reagieren, untersuchen Biophysiker mit der Einzelmolekül-Kraftspektroskopie. Dabei wird das zu untersuchende Biomolekül zwischen zwei anderen Molekülen befestigt und dann der Abstand zwischen diesen langsam vergrößert. Ein beliebtes Werkzeug für die Befestigung von Biomolekülen ist die Interaktion des Vitamins Biotin mit dem Protein Streptavidin. „Dieses Rezeptor-Liganden-System ist quasi der Fischer-Dübel der Biophysik“, sagt Team-Mitglied Steffen Sedlak.
Das zu untersuchende Biomolekül bindet dabei an Biotin, das wiederum mit hoher Affinität an Streptavidin bindet. Die mechanische Stabilität der Interaktion von Biotin und Streptavidin spielt für die Experimente eine wichtige Rolle. Nachdem Gaub das System vor 25 Jahren erstmals kraftspektroskopisch untersucht hatte, wurde sie in zahlreichen Labors auf der ganzen Welt gemessen. Dabei waren die Ergebnisse uneinheitlich und erstreckten sich über einen recht großen Bereich. Die Gründe dafür haben die Wissenschaftler jetzt untersucht.
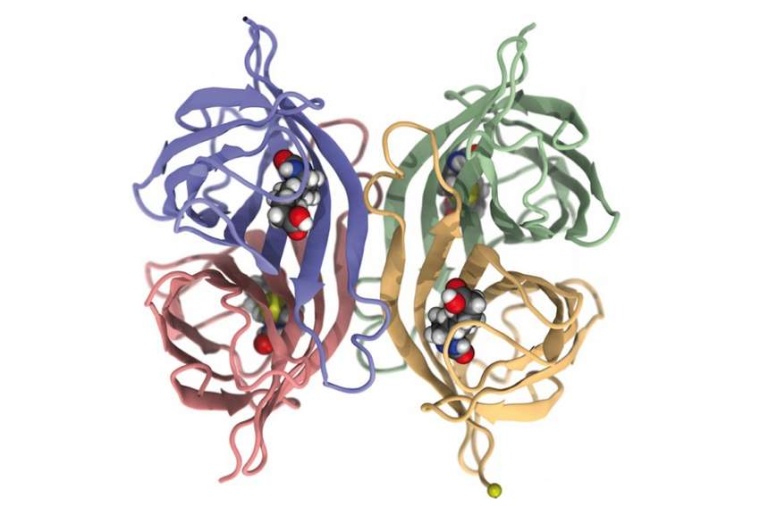
Streptavidin besteht aus vier gleichen Untereinheiten, die man sich als zylinderförmige Hohlräume vorstellen kann. In jedes dieser „Fässer“ kann ein Biotin-Molekül binden. Wie bei echten Fässern gibt es auch für die Streptavidin-Untereinheiten einen Deckel. Dieser schließt sich, sobald Biotin gebunden hat. Dann ragt nur noch ein Ende von Biotin durch eine kleine Öffnung aus dem Fass, an diesem Ende ist das zu untersuchende Biomolekül befestigt.
Für ihre Untersuchungen entwarfen die Wissenschaftler spezielle Streptavidin-Varianten, die jeweils nur mit einer bestimmten Untereinheit Biotin binden konnten – die restlichen drei Fässer blieben dabei leer. Um die Stabilität der Bindung zu untersuchen, zogen die Wissenschaftler dann einzelne Biotine aus dieser Tasche „Dabei haben wir entdeckt, dass unterschiedlich viel Kraft benötigt wird, je nachdem, aus welchem der vier Fässer Biotin herausgezogen wird – und das obwohl die vier Bindungstaschen exakt gleich sind“, sagt Gaub.
Mithilfe aufwändiger Computersimulationen gelang es den Wissenschaftlern, die Ursache dieser Unterschiede aufzuklären: Die Bindungstaschen nehmen relativ zu dem Punkt, an dem die Zugbelastung ansetzt, unterschiedliche Positionen ein. Daraus ergeben sich verschiedene Zuggeometrien: Besonders leicht gibt die Bindung nach, wenn Biotin bei Belastung gegen den flexiblen Deckel des Fasses drückt. Wird die Bindung jedoch an anderen Stellen belastet, kann das System sehr hohe Kräfte aushalten. Die Wissenschaftler sind davon überzeugt, dass ihre Erkenntnisse dazu beitragen werden, Streptavidin zukünftig optimal einzusetzen – nun kann der molekulare Dübel so befestigt werden, dass er mechanisch besonders stabil ist.
LMU / RK
Weitere Infos
- Originalveröffentlichung
S. M. Sedlak et al.: Streptavidin/biotin: Tethering geometry defines unbinding mechanics, Sci. Adv. 6, eaay5999 (2020); DOI: 10.1126/sciadv.aay5999 - Angewandte Physik und Biophysik (H. Gaub), Fklt. für Physik und Center for Nanoscience, Ludwig-Maximilians-Universität München
- Molecular Science and Engineering, Beckman Institute for Advanced Science and Technology, University of Illinois at Urbana-Champaign, Urbana, USA











