Dynamische Sonden für Biomoleküle
Schwingungen von Phosphatgruppen geben Einblick in Wechselwirkungen und Strukturen.
DNA und RNA sind geladene Polymere, die genetische Informationen in einer Doppelhelixstruktur kodieren und eine Schlüsselrolle bei der Biosynthese von Proteinen spielen. Ihre negativen Ladungen sind im molekularen Rückgrat angeordnet, das aus ionischen Phosphatgruppen und Zuckerringstrukturen besteht. Eine Stabilisierung der makromolekularen DNA- und RNA-Strukturen erfordert die Kompensation der stark abstoßenden elektrischen Kräfte zwischen den Phosphatgruppen durch Ionen entgegengesetzter Ladung. Hierbei sind Magnesium-Ionen besonders wichtig, da sie über die Stabilisierung der Strukturen hinaus auch externe Bindungspartner erkennen und als katalytische Zentren dienen. Veränderungen der makromolekularen Struktur sind bei Faltungsprozessen mit einer Umordnung der positiven Ionen und der umgebenden Wasserhülle verbunden.
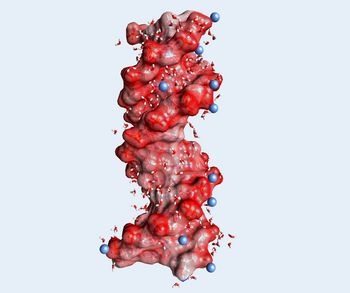
Positive Ionen in der Umgebung von DNA und RNA existieren in unterschiedlichen Geometrien. In Kontakt-Ionenpaaren ist ein positives Ion in direkter räumlicher Nachbarschaft eines Sauerstoffatoms der Phosphatgruppe angeordnet. Hingegen besteht die äußere Ionenatmosphäre aus positiven Ionen, die durch mindestens eine Schicht von Wassermolekülen von den Phosphatgruppen getrennt sind. Die funktionellen Eigenschaften der verschiedenen Geometrien und ihre Wechselwirkungen sind bisher nur teilweise verstanden. Eine tiefere Einsicht auf molekularem Niveau erfordert hochempfindliche Sonden, welche die verschiedenen Geometrien unterscheiden ohne sie zu verändern und ihre Dynamik auf der ultrakurzen Zeitskala molekularer Bewegungen verfolgen können.
Wissenschaftler des Max-Born-Instituts zeigten jetzt, dass Schwingungsanregungen der Phosphatgruppen empfindliche nichtinvasive Sonden darstellen, mit denen sich Ionen-Geometrien in einer Wasserumgebung unterscheiden lassen. In den Experimenten wurde Dimethylphosphat, ein etabliertes Modellsystem für das DNA- und RNA-Rückgrat, in Wasser mit einem Überschuss von Magnesium-Ionen präpariert und mittels nichtlinearer Schwingungsspektroskopie im Femtosekundenzeitbereich untersucht. Die Experimente beruhen auf zweidimensionaler Infrarot-Spektroskopie – einer ausgereiften und sehr aussagekräftigen Methode, um ionische Wechselwirkungen und Geometrien zu studieren.
In den Experimenten werden Magnesium-Ionen in direktem Kontakt mit einer Phosphatgruppe ersmals durch eine neue separate Bande im 2D-IR-Spektrum nachgewiesen. Die Kopplung an das Magnesium-Ion verschiebt die asymmetrische Streckschwingung der Phosphatgruppe zu einer höheren Frequenz als in Abwesenheit von Magnesium-Ionen. Die Linienform und die zeitliche Entwicklung der neuen Bande machen Fluktuationen der Ionenpaar-Geometrie und der umgebenden Wasserhülle auf der Zeitskala einiger hundert Femtosekunden sichtbar, während die Paargeometrie selbst für viel längere Zeit erhalten bleibt. Eine genaue theoretische Analyse zeigt, dass die subtile Balance zwischen anziehenden elektrischen Kräften und abstoßenden Kräften, die von der quantenmechanischen Austauschwechselwirkung herrühren, die Frequenzposition der Phosphatschwingung bestimmen.
Mit der Charakterisierung der kurzreichweitigen Phosphat-Ionen-Wechselwirkung in Lösung durch 2D-IR-Spektroskopie steht ein neuartiges analytisches Werkzeug zur Verfügung, das statische Techniken der Strukturaufklärung erweitert. Eine Anwendung dieses neuen Konzepts auf DNA und RNA und ihre ionische Umgebung erscheint vielversprechend und wird zur Aufklärung der Mechanismen beitragen, die Biomoleküle im Gleichgewicht stabilisieren und Faltungsprozesse treiben.
FV Berlin / RK
Weitere Infos
- Originalveröffentlichung
J. Schauss et al.: Phosphate-magnesium ion interactions in water probed by ultrafast two-dimensional infrared spectroscopy, J. Phys. Chem. Lett. 10, 238 (2019); DOI: 10.1021/acs.jpclett.8b03568 - Nichtlineare Prozesse in kondensierter Materie (T. Elsässer), Max-Born-Institut für nichtlineare Optik und Kurzzeitspektroskopie, Berlin











