Geschärfte Bildgebung
Zellstoffwechsel durch spezielle MRT-Verfahren sichtbar machen.
Mit Hilfe der Magnetresonanztomografie (MRT) lassen sich in der heutigen Medizin vor allem die Weichteile im menschlichen Körper sehr gut darstellen – und helfen in der Diagnostik, Veränderungen wie Tumoren zu erkennen. Viele Erkrankungen lösen allerdings bereits Veränderungen im Zellstoffwechsel aus, bevor im MRT tatsächlich eine substanzielle Strukturveränderung des Gewebes zu erkennen ist. Ein interdisziplinäres Forschungsteam der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) um Moritz Zaiß, Professur für multimodale Bildgebung in der klinischen Forschung, und der Technischen Universität Graz arbeitet jetzt an einem Verfahren, um bereits diese Stoffwechseländerungen im MRT sichtbar zu machen und so einen wichtigen Beitrag für die Früherkennung von Krankheiten durch MR-Biomarker zu leisten. Das Projekt, an dem Wissenschaftler aus den Fachbereichen Physik, Radiologie, Ingenieurwesen und Mathematik mitarbeiten, wird von der Deutschen Forschungsgemeinschaft und dem österreichischen Fonds zur Förderung wissenschaftlicher Forschung mit 650.000 Euro gefördert.
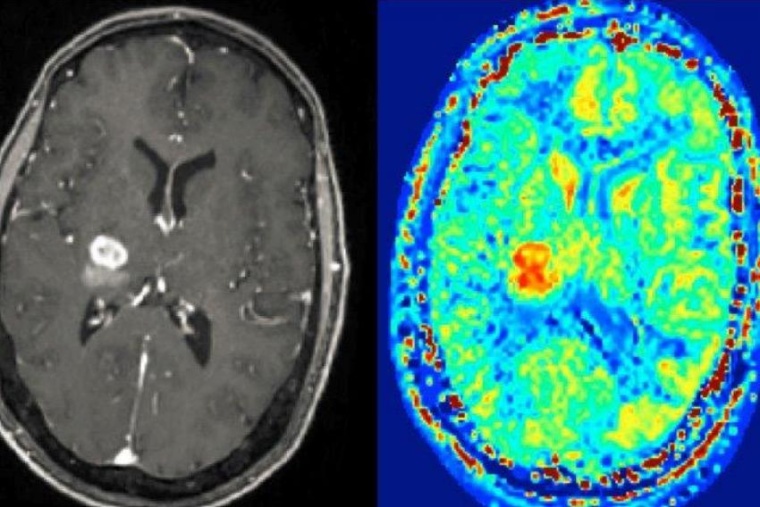
Magnetresonanztomografie erlaubt es, die Weichteile des Körpers und verschiedene Gewebetypen mit einer hohen räumlichen Auflösung darzustellen. Der Grund: Mit Hilfe des Magnetfeldes im MRT lassen sich die Protonen im Kern von Wasserstoffatomen räumlich aufgelöst messen – und damit auch das Körpergewebe, das ja zu großen Teil aus Wasser besteht. Für die Diagnostik, gerade für die Früherkennung bestimmter Erkrankungen, wäre es allerdings wichtig, Gewebeveränderungen bereits in einem Stadium zu identifizieren, wenn sich lediglich im Zellstoffwechsel Unregelmäßigkeiten finden – typische frühe Anzeichen, dass etwas mit der Zelle nicht stimmt. Könnte man diesen Zellstoffwechsel ebenfalls in 3D sichtbar machen und auf diese Weise feststellen, wie hoch zum Beispiel der Kreatin-Gehalt oder der pH-Wert an bestimmten Stellen im Gewebe ist, wäre dies ein immenser Gewinn für die Medizin. Denn solche Werte sind häufig Biomarker, also messbare Hinweise im Körper auf bestimmte Erkrankungen.
Grundsätzlich könnte die Magnetresonanztomografie dies leisten, gerade die neuen leistungsstarken Hochfeld-Magnetresonanztomografen mit Feldstärken von sieben Tesla oder mehr. In verschiedenen Molekülen nämlich, die in der zellulären Struktur oder im Zellstoffwechsel vorkommen – etwa Proteine und Stoffwechselzwischenprodukte (Metabolite) – sind ebenfalls Wasserstoffatome enthalten, allerdings in deutlich geringerer Konzentration als in Wasser selbst. Ein Lösungsansatz ist CEST-MRT: Die Abkürzung CEST steht für den „chemical exchange saturation transfer“, ein Verfahren, das sich den chemischen Prozess des Protonenaustauschs zu Nutze macht, um die Sensitivität des MRT so zu erhöhen, dass es auch auf die geringen Konzentrationen von Wasserstoffprotonen in Proteinen und Metaboliten anspringt. Das interessante an der CEST-MRT-Methode ist, dass sie nicht-invasiv ist und keine Kontrastmittel benötigt.
Für eine Nutzung von CEST-MRT als Standard in der Diagnostik sind allerdings noch einige Hürden zu nehmen: Aktuell zum Beispiel dauert eine Untersuchung, um genügend hohe Mengen an Daten zu erheben, noch zu lange und könnte Patienten überfordern. Auch die Auswertung der Datenmassen und die optimale Steuerung des CEST-MRT – die Forscher setzen dafür Radiofrequenzsignale ein – sind ungelöste Probleme.
Moritz Zaiß und seine Kollegen wollen zwei Lösungsansätze parallel verfolgen: Zum einen setzen sie darauf, perfekte passende Radiofrequenzsignale zu entwickeln. Gleichzeitig wollen sie die Untersuchung durch neuartige Mess- und Rekonstruktionsverfahren um mehr als das Zehnfache beschleunigen. Dafür arbeiten sie vor allem am Ultra-Hochfeld-MRT Magnetom Terra, den Wissenschaftler der FAU und des Universitätsklinikums Erlangen selbst mit entwickelt haben. So hoffen die Forscher, einen entscheidenden Beitrag zu leisten für eine bessere und patientenfreundliche Erfassung molekularer Information durch die Magnetresonanzbildgebung – und damit eine Basis zu schaffen für eine breitere klinische Anwendung in der Biomarker-Bildgebung und der Präzisionsmedizin.
FAU / DE











