Quantenphysik in Proteinen
Künstliche Intelligenz liefert zuvor unerreichte Einblicke in die Funktion von Biomolekülen.
Eine neue Analysemethode liefert bislang unerreichbare Einblicke in die extrem schnelle Dynamik von Biomolekülen. Ein Forscherteam um Abbas Ourmazd von der University of Wisconsin in den USA und Robin Santra vom DESY hat die Kombination aus Quantenphysik und Molekularbiologie entwickelt und konnte damit verfolgen, wie das photoaktive gelbe Protein in weniger als einer billionstel Sekunde seine Struktur ändert, nachdem es durch Licht angeregt worden ist.
„Um biochemische Vorgänge wie beispielsweise die Photosynthese in bestimmten Bakterien genau zu verstehen, ist es wichtig, den detaillierten Ablauf zu kennen“, erläutert Santra die Motivation. „Wenn photoaktive Proteine von Licht getroffen werden, ändern sie ihre räumliche Struktur, und diese Strukturänderung bestimmt die Rolle, die ein Protein in der Natur übernimmt.“ Bislang ist es allerdings kaum möglich, den genauen Verlauf solcher Strukturänderungen zu verfolgen. Es lassen sich lediglich Anfangs- und Endzustand eines Moleküls vor und nach einer Reaktion bestimmen und theoretisch deuten. „Aber wie die Energie- und Formänderung dazwischen genau abläuft, wissen wir nicht“, so Santra.
Der Energiezustand eines Moleküls lässt sich sehr genau mit Hilfe der Spektroskopie bestimmen. Und zur Analyse der Form von Molekülen nutzen Forscher die Strahlung eines Röntgenlasers. Dank der sehr kurzen Wellenlänge lassen sich so sehr kleine räumliche Strukturen entschlüsseln, etwa die Positionen der Atome in einem Molekül. Allerdings entsteht dabei kein Abbild wie bei einem Foto, sondern ein charakteristisches Streumuster der Röntgenstrahlen, aus dem sich die räumliche Struktur berechnen lässt.
Da die Bewegung auf der Molekülebene extrem schnell ist, müssen die Wissenschaftler äußerst kurze Röntgenblitze verwenden, weil die Aufnahme sonst verschmiert. Erst mit der Erfindung der Röntgenlaser ist es möglich, ausreichend helle und kurze Röntgenblitze zu produzieren, um diese Dynamik festzuhalten. Da sich die Moleküldynamik im Bereich der Quantenphysik abspielt, lassen sich die Messungen ohne eine quantenphysikalische Analyse allerdings nicht verstehen.
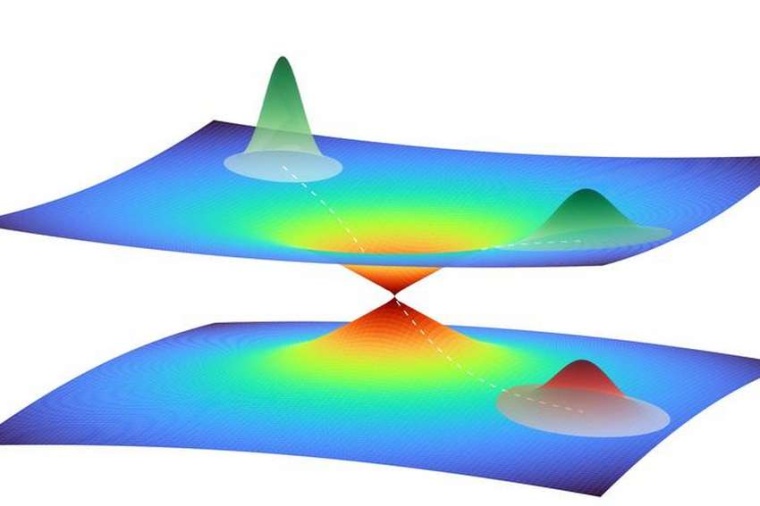
Dabei gibt es eine Besonderheit der photoaktiven Proteine zu beachten: Durch das eingestrahlte Licht geht ihre Elektronenhülle in einen angeregten Quantenzustand über, der eine erste Formänderung des Moleküls bewirkt. Diese Formänderung wiederum kann zu einer Überschneidung des angeregten und des Grund-Quantenzustands führen. Die Folge ist ein Quantensprung vom angeregten zurück in den Grundzustand, wobei die geänderte Form des Moleküls zunächst bestehen bleibt. Die trichterförmige Überschneidung der Quantenzustände heißt konische Durchschneidung und öffnet einen Pfad zu einer neuen räumlichen Struktur des Proteins im quantenmechanischen Grundzustand.
Dem Team um Santra und Ourmazd ist es nun erstmals gelungen, die Strukturdynamik eines photoaktiven Proteins an einer solchen trichterförmigen Überschneidung zu enträtseln. Dabei griffen sie auf Hilfe durch maschinelles Lernen zurück. Denn für eine solche Beschreibung der Dynamik müssten eigentlich alle Bewegungsmöglichkeiten aller beteiligten Teilchen betrachtet werden. Das führt jedoch schnell zu unübersichtlichen, nicht mehr lösbaren Rechnungen.
„Das photoaktive gelbe Protein, das wir untersucht haben, besteht aus etwa zweitausend Atomen“, berichtet Santra. „Da sich jedes Atom grundsätzlich in allen drei Raumdimensionen bewegen kann, gibt es insgesamt 6000 Bewegungsoptionen. Das führt zu einer quantenmechanischen Rechnung mit 6000 Dimensionen – und die ist selbst mit den heute leistungsstärksten Computern nicht lösbar.“
Per Computeranalyse basierend auf maschinellem Lernen ließen sich jedoch kollektive Bewegungsmuster der Atome in dem komplexen Molekül identifizieren. Der Computer konnte die 6000 Dimensionen auf diese Weise auf vier reduzieren. Mit der Demonstration dieser neuen Methode kann Santras Team auch erstmals eine konische Durchschneidung von Quantenzuständen in einem komplexen Molekül aus Tausenden von Atomen charakterisieren.
Die detaillierte Rechnung zeigt, wie sich dieser konische Trichter in dem vierdimensionalen Raum bildet und das photoaktive gelbe Protein durch ihn nach einer Anregung mit Licht seine Struktur ändert und dabei wieder in den Ausgangsquantenzustand zurückfällt. Diesen Ablauf können die Wissenschaftler nun in Schritten von einigen Dutzend Femtosekunden beschreiben und so zum Verständnis der photoaktiven Prozesse beitragen. „So liefert die Quantenphysik neue Einblicke in ein biologisches System, und die Biologie bringt neue Anregungen für die quantenmechanische Methodik“, sagt Santra, „Beide Gebiete befruchten sich dabei gegenseitig.“
DESY / RK
Weitere Infos
- Originalveröffentlichung
A. Hosseinizadeh et al.: Few-fs resolution of a photoactive protein traversing a conical intersection, Nature, online 3. November 2021; DOI: 10.1038/s41586-021-04050-9 - Ultraschnelle Prozesse in intensiven Strahlungsfeldern (R. Santra), Deutsches Elektronen-Synchrotron, Hamburg
- A. Ourtmazd Research Group, Physics, College of Letters & Science, University of Wisconsin-Milwaukee, USA













