Mit dem europäischen Röntgenlaser European XFEL hat ein internationales Forschungsteam neue Einblicke in die Entstehung von Strahlenschäden in biologischem Gewebe gewonnen. Die Untersuchung enthüllt erstmals im Detail, auf welche Weise Wassermoleküle durch energiereiche Strahlung in potenziell gefährliche Radikale und elektrisch geladene Ionen auseinanderbrechen, die im Organismus dann schädliche Reaktionen auslösen können. Da Wasser in jedem lebenden Organismus vorkommt, steht diese Photolyse von Wasser, also die Spaltung der Wassermoleküle durch energiereiche Strahlung, oft am Beginn der Entstehung von Schäden.
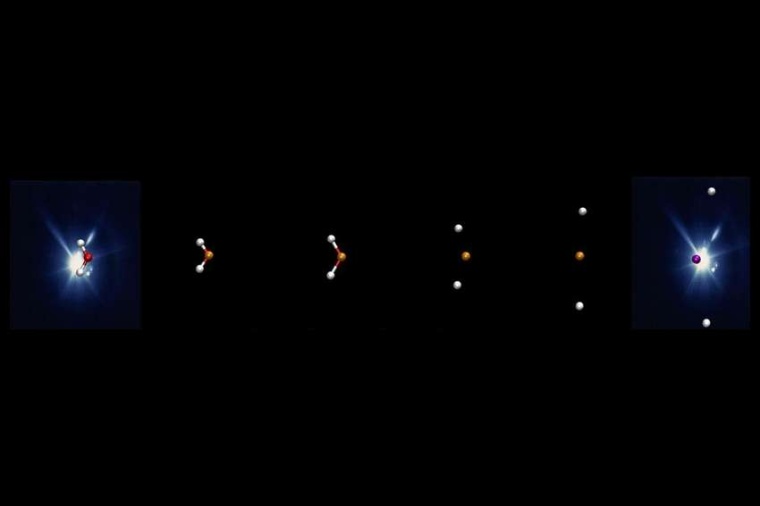
„Die Kette von Reaktionen, die von energiereicher Strahlung im Körper ausgelöst werden kann, ist allerdings bis heute nicht voll verstanden“, erläutert Ludger Inhester vom DESY. „So ist es bereits sehr schwierig, die Entstehung einzelner geladener Ionen und reaktiver Radikale in Wasser zu verfolgen, die nach der Absorption hochenergetischer Strahlung entstehen.“
Um diese Abfolge zu untersuchen, beschossen die Forscher Wasserdampf mit den Blitzen des Röntgenlasers. Ein Wassermolekül zerfällt normalerweise bereits durch die Absorption eines einzelnen derart energiereichen Röntgenphotons. „Durch die besonders intensiven Pulse des Röntgenlasers war es sogar möglich, Wassermoleküle zu beobachten, die nicht nur ein, sondern zwei oder noch mehr Röntgenphotonen absorbieren, bevor die Bruchstücke auseinander geflogen sind“, berichtet Inhester. Das ermöglicht den Forschern einen Blick darauf, was im Molekül nach der ersten Absorption eines Röntgenphotons vor sich geht.
„Die Bewegung des Moleküls zwischen zwei Absorptionen hinterlässt einen eindeutigen Fingerabdruck, das heißt, seine Bruchstücke fliegen auf ganz spezifische, unverkennbare Art und Weise auseinander“, sagt Maria Novella Piancastelli von der Uni Sorbonne Université Paris. „Durch die genaue Analyse dieses Fingerabdrucks sowie detaillierte Simulationen konnten wir daher Rückschlüsse auf die ultraschnelle Dynamik des Wassermoleküls nach der Absorption des ersten Röntgenphotons gewinnen.“
Flugrichtungen und -geschwindigkeiten der Bruchstücke hat das Team mit einem Reaktionsmikroskop gemessen. Auf diese Weise war es möglich, das nur wenige Femtosekunden dauernde Auseinanderbrechen des Wassermoleküls in Wasserstoff- und Sauerstoff-Ionen wie in Zeitlupe darzustellen.
Der Zerfall des Wassermoleküls läuft demnach deutlich komplexer ab als zunächst erwartet. Das Molekül beginnt sich zu dehnen und zu strecken, bevor es schließlich auseinanderbricht. Die beiden Wasserstoffatome, die normalerweise im Winkel von 104 Grad an das Sauerstoffatom gebunden sind, können sich dabei so weit aufschaukeln, dass sie sich nach nur zehn Femtosekunden mit etwa 180 Grad gegenüberstehen. Das Sauerstoffatom wird dadurch beim Zerbrechen des Moleküls nicht so stark weggeschleudert, weil sich die Impulse der beiden wegfliegenden Wasserstoffkerne nahezu ausgleichen und der Sauerstoff weitgehend ruhend in der Mitte bleibt. In wässriger Umgebung kann dieses freie Sauerstoffradikal dann leichter zu weiteren potenziell schädlichen chemischen Reaktionen führen.
„In unserer Arbeit ist es zum ersten Mal gelungen, die Dynamik eines Wassermoleküls nach Absorption hochenergetischer Strahlung genauer zu betrachten“, sagt Inhester. „Wir konnten insbesondere die Entstehung des Sauerstoffradikals und der Wasserstoffionen sowie den Zeitablauf dieses Vorgangs genauer charakterisieren. Dieser Zerfallsprozess des Wassermoleküls ist ein wichtiger initialer Schritt für weitere Reaktionsketten, die am Ende zu Strahlungsschäden führen.“
Die Analyse ergänzt das Bild von der Strahlungswirkung auf Wasser. Eine vorangegangene Studie, an der Mitglieder desselben Teams beteiligt waren, hatte die Entstehung freier Radikale durch weniger energiereiche Strahlung in Wasser detailliert erkundet. Die dabei beobachteten Prozesse haben eine ähnliche Dynamik wie die Sekundärprozesse in der jetzt untersuchten Absorption hochenergetischer Strahlung. Die neu gewonnenen Einsichten adressieren elementare Fragen über Reaktionsdynamiken in Wasser, zu deren weiterer Erforschung derzeit das Centre for Molecular Water Science mit internationalen Partnern bei DESY aufgebaut wird.
Die neuen Experimente an einzelnen Wassermolekülen gehörten zu den ersten, die mit einem neuen Reaktionsmikroskop COLTRIMS an der SQS-Experimentierstation des European XFEL stattgefunden haben. „Die Ergebnisse zeigen, dass wir auch andere Lösungsmittel und Moleküle mit komplexerer Struktur wie Ethanol oder zyklische Verbindungen untersuchen können, die in der Chemie und anderen Disziplinen von großem Interesse sind“, erläutert Till Jahnke vom European XFEL.
DESY / RK
Weitere Infos
- Originalveröffentlichung
T. Jahnke et al.: Inner-Shell-Ionization-Induced Femtosecond Structural Dynamics of Water Molecules Imaged at an X-Ray Free-Electron Laser, Phys. Rev. X 11, 041044 (2021); DOI: 10.1103/PhysRevX.11.041044 - SQS – Small Quantum Systems, European XFEL, Schenefeld
- Center for Free-Electron Laser Science, Deutsches Elektronen-Synchrotron, Hamburg
- Laboratoire de Chimie Physique-Matière et Rayonnement Sorbonne Université, Paris, Frankreich













