Wie Elektrolyte metallisch werden
BESSY II-Experiment zeigt erstmals die Bildung eines metallischen Leitungsbandes in Elektrolyten.
In einem Metall bewegt sich ein Teil der äußeren Elektronen im Leitungsband durch das kristalline Gitter. Daher leiten Metalle elektrischen Strom. Im Gegensatz zu Metallen sind in Elektrolyten die Ionen ungeordnet und die Leitfähigkeit nimmt sogar mit steigender Konzentration ab. Wie entsteht daher aus vielen einzelnen, gelösten Metall-Atomen im Elektrolyten ein metallisches Verhalten? Wie genau und bei welcher Konzentration bildet sich ein Leitungsband aus und wie verhalten sich die Orbitale dabei? Ein internationales Team hat jetzt ein raffiniertes Experiment entwickelt, mit dem sich diese Vorgänge erstmals beobachten lassen.
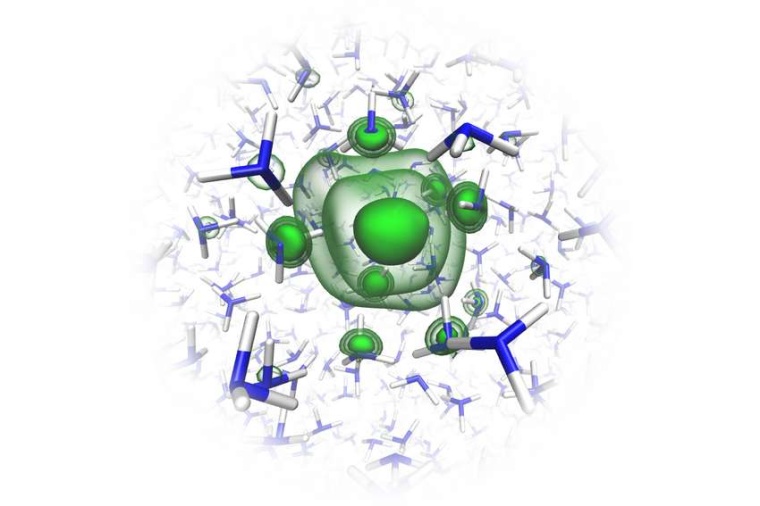
Im ersten Schritt stellten die Forscher Lösungen von Alkali-Metallen wie Lithium und Natrium in Ammoniak her. Dabei bilden sich positiv geladene Metall-Ionen und Elektronen gehen in Lösung. Diese Lösungen sind bei niedrigen Konzentrationen schwach blau, bei steigender Konzentration intensiviert sich die blaue Farbe bis sie dann plötzlich zu einem goldenen Farbton umschlägt. Dieser Farbwechsel hängt mit den Zuständen der gelösten Metall-Elektronen zusammen, vermuteten die Wissenschaftler.
An der SOL³PES-Maschine an der Beamline U49/2-PGM-1 von Bessy II konnten die Forscher dann Mikrojets aus den Ammoniak-Lösungen mit unterschiedlichen Alkali-Konzentrationen im Ultrahochvakuum mittels Photoelektronen-Spektroskopie untersuchen. Dabei mussten die Lösungen auf etwa minus sechzig Grad Celsius gekühlt werden. Bei dieser Temperatur ist Ammoniak flüssig und die Verdampfung hinreichend gering. Tatsächlich konnten sie so den Übergang vom Elektrolyten zum Metall genau vermessen.
„Wir konnten zum ersten Mal das Photoelektronen-Signal der überschüssigen Elektronen in flüssigem Ammoniak einfangen. Wir beobachten einen Peak bei etwa zwei Elektronenvolt, der das Vorhandensein von gelösten Elektronen und Di-Elektronen anzeigt“, sagt Team-Mitglied Bernd Winter vom Fritz-Haber-Institut Berlin. Und Robert Seidel vom Helmholtz-Zentrum Berlin für Materialien und Energie ergänzt: „Das erklärt auch, warum die Lösung bei niedrigen und mittleren Metall-Konzentrationen zunächst blau ist. Die Lösung absorbiert Licht im roten Bereich, was dem Peak von 2 eV entspricht.“ Dadurch erscheint die Lösung schwach blau, solange es nur einzelne gelöste Elektronen gibt. Diese blaue Farbe intensiviert sich noch mit dem Erscheinen von ersten Di-Elektronen. Mit zunehmender Alkalimetall-Konzentration wechselt die Farbe ins Goldene. Gleichzeitig verbreitert sich der Peak zu einem Band mit der für Metalle charakteristischen, scharfen Fermi-Kante im Spektrum sowie mit Signalen, die charakteristisch für kollektive Anregungen freier Elektronen sind.
Die Forscher konnten die Messdaten so eindeutig interpretieren, weil Team-Mitglieder der Uni Prag die elektronische Struktur von solvatisierten Elektronen in Lösung vorab modelliert hatten. Die berechneten Bindungsenergien passen sehr gut zu den experimentell ermittelten Werten. Die Arbeit liefert einen wichtigen Beitrag zum grundlegenden Verständnis des Übergangs von nichtleitendem zu metallischem Charakter in Elektrolyten. Dieses Verständnis ist auch für praktische Anwendungen hilfreich, so spielen solvatisierte Elektronen in der organischen Chemie als Reduktionsmittel für aromatische Systeme eine Rolle, aber auch in Batterie-Elektrolyten und Kondensatoren.
HZB / RK
Weitere Infos
- Originalveröffentlichung
T. Buttersack et al.: Photoelectron spectra of alkali metal–ammonia microjets: From blue electrolyte to bronze metal, Science 368, 1086 (2020); DOI: 10.1126/science.aaz7607 - Winter Group, Fritz-Haber-Institut Berlin
- Grenzflächen-Photochemie (R. Seidel), Helmholtz-Zentrum Berlin für Materialien und Energie GmbH













