Wie Lipide Informationen übertragen
Grundlegende zelluläre Mechanismen zugänglich gemacht.
Lipide haben in unserem Körper viele Funktionen: So bilden sie Membranbarrieren, speichern Energie oder sind als Botenstoffe unterwegs und regulieren so zum Beispiel Zellwachstum und Hormonausschüttung. Viele von ihnen sind auch Biomarker für schwere Krankheiten. Bisher ist es jedoch sehr schwierig, die Funktionen dieser Moleküle in lebenden Zellen zu analysieren. Forscher des Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG) in Dresden und des Leibniz-Institut für Molekulare Pharmakologie (FMP) in Berlin haben nun chemische Werkzeuge entwickelt, die durch Licht aktiviert werden und mit deren Hilfe sich die Lipid-Konzentration in lebenden Zellen beeinflussen lässt. Mit diesem Ansatz könnten Ärzte gemeinsam mit Biochemikern und Biophysikern herausfinden, was Moleküle in einer Zelle tatsächlich tun.
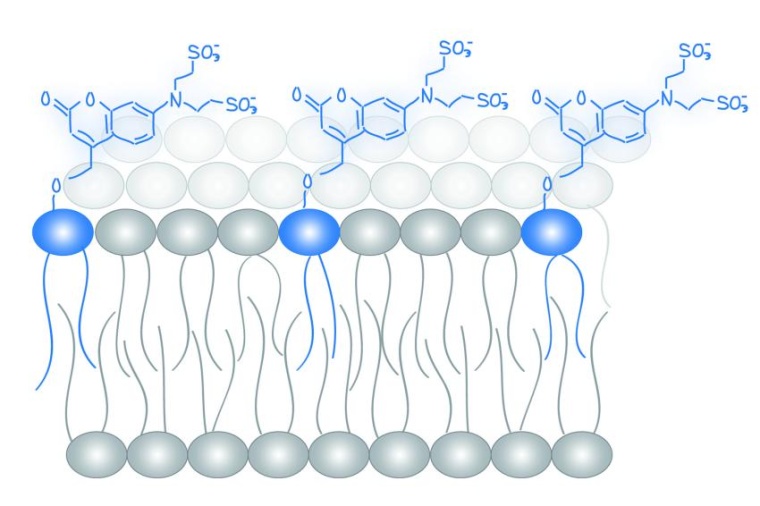
In jeder Zelle werden tausende verschiedener Lipide gebildet. Allerdings gibt es bisher wenig Wissen darüber, wie diese chemische Lipid-Vielfalt zur Übertragung von Botschaften in der Zelle beiträgt – mit anderen Worten, der Lipid-Code der Zelle ist noch nicht bekannt. Das liegt vor allem am Mangel an Methoden zur quantitativen Untersuchung der Lipidfunktion in lebenden Zellen. Ein Verständnis über das Wirken von Lipiden ist sehr wichtig, da sie die Funktion von Proteinen in der ganzen Zelle kontrollieren und daran beteiligt sind wichtige Stoffe durch die Zellmembran in die Zelle zu bringen. Das faszinierende an Lipiden, die als Boten-Moleküle fungieren, ist, dass an der Innenseite der Zellmembran nur eine begrenzte Zahl von Lipidenklassen als Botenstoffe zu dienen, diese aber Botschaften von tausenden verschiedenen Rezeptoren-Proteinen bekommen. Wie diese vielen Botschaften aber trotzdem gut erkannt und weitergeleitet werden können, war bisher eine ungelöste Frage.
Die Forschungsgruppen um André Nadler am MPI-CBG und Alexander Walter am FMP haben in Zusammenarbeit mit der TU Dresden chemische Werkzeuge entwickelt, mit dem man die Konzentration von Lipiden in lebenden Zellen steuern kann. Aktiviert wird dieses Werkzeug durch Licht. Milena Schuhmacher, die Erstautorin der Studie, erklärt: „Lipide sind eigentlich keine einzelnen molekularen Strukturen, sondern unterscheiden sich in winzigen chemischen Details, zum Beispiel haben einige längere Fettsäureketten und manche etwas kürzere. Wir konnten mithilfe ausgeklügelter Mikroskopie in lebenden Zellen und mathematischen Modellierungsansätzen zeigen, dass die Zelle diese winzigen Veränderungen durch spezielle Effektor-Proteinen tatsächlich erkennen und so möglicherweise zur Übertragung von Informationen nutzen können. Hierbei war es wichtig, dass wir ganz genau kontrollieren konnten, wieviel von jedem einzelnen Lipid vorhanden war.“
André Nadler, der die Studie betreute, ergänzt: „Diese Ergebnisse deuten auf die Existenz eines Lipidcodes hin, der von Zellen genutzt wird, um Information, die auf der Außenseite der Zelle detektiert werden, auf der Innenseite der Zelle wieder neu zu codieren.“
Die Ergebnisse der Studie könnten es Membran-Biophysikern und Lipid-Biochemikern ermöglichen, ihre Ergebnisse mit quantitativen Daten lebender Zellen zu überprüfen. André Nadler weist darauf hin: „Auch Kliniker könnten von unserer neu entwickelten Methode profitieren. Bei Erkrankungen, wie Diabetes und Bluthochdruck, hat man mehr Lipide, die als Biomarker fungieren, im Blut. Diese kann man mit einem Lipidprofil veranschaulichen. Mithilfe unserer Methode, könnten die Ärzte nun genau sehen, was die Lipide genau im Körper machen. Das war bisher nicht möglich.“
MPI-CBG / DE
Weitere Infos
- Originalveröffentlichung
M. Schuhmacher et al.: Live cell lipid biochemistry reveals a role of diacylglycerol side chain composition for cellular lipid dynamics and protein affinities, PNAS, online 25. März 2020; DOI: 10.1073/pnas.1912684117 - Membrane Chemical Biology (A. Nadler), Max-Planck-Institut für molekulare Zellbiologie und Genetik











