Wie vorne und hinten entsteht
Geometrische Musterbildung spielt entscheidende Rolle für erste Zellteilung.
Die richtige Verteilung von Proteinen in der Zelle ist für viele biologische Prozesse essenziell. Die Zellteilung und das Wachstum etwa werden durch Proteinmuster gesteuert, die die Orientierung der Zellteilung und den Teilungsort festlegen. Ein wichtiges Beispiel dafür ist die erste Zellteilung bei dem Fadenwurm Caenorhabditis elegans, einem gängigen Modellorganismus vor allem in der Entwicklungsbiologie. Diese erste Teilung wird durch PAR-Proteine reguliert. Solche lebenswichtigen Prozesse müssen sehr stabil ablaufen. Der LMU-Biophysiker Erwin Frey hat nun mit seinem Team zwei entscheidende Mechanismen identifiziert, die die robuste Ausrichtung des PAR-Protein Musters entlang der langen zellulären Achse möglich machen.
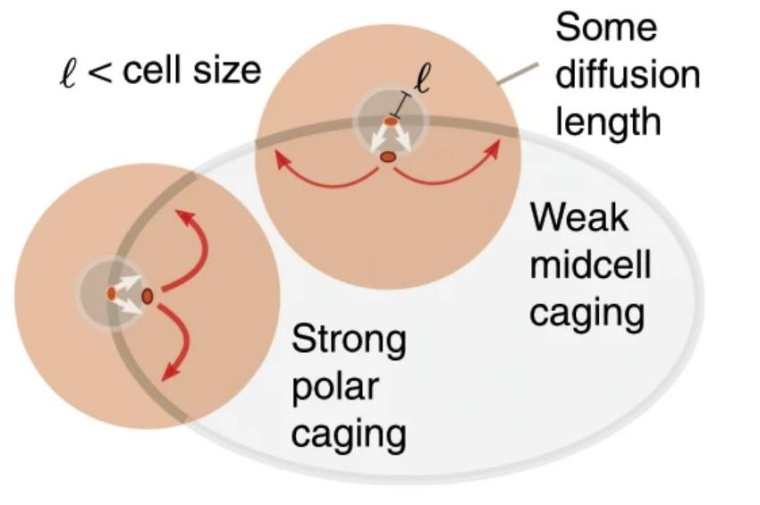
Der längliche Embryo C. elegans wird bei seiner ersten Teilung in eine Kopf- und eine hintere Zelle geteilt. Die PAR-Proteine legen fest, wo im Embryo vorne und wo hinten ist, indem sie ein Muster auf der Zellmembran bilden: Eine Gruppe der PAR-Proteine, die anterior PARs (aPARs) siedeln sich an einem Zellpol an, und legen dadurch die Vorderseite fest. Die posterior PARs (pPARs) binden an den gegenüberliegenden Zellpol und legen damit die Hinterseite fest. Kurz nach der Befruchtung sind allerdings alle PAR-Proteine noch gleichmäßig in der Zelle verteilt, denn sie können frei durch die Zelle diffundieren und prinzipiell überall an die Zellmembran binden. „Wir haben nun mit mathematischen Modellen und numerischen Simulationen untersucht, welche Mechanismen zur Musterbildung führen und welche Mechanismen das Muster in einer bestimmten Achse in zellulärer Geometrie ausrichten“, sagt Raphaela Geßele, Doktorandin in Freys Team und Erstautorin der Arbeit.
Dabei zeigte sich, dass chemische Zyklen zwischen phosphorylierten und dephosphorylierten Zuständen eine entscheidende Rolle spielen: Die beiden PAR-Gruppen können sich gegenseitig von der Membran verdrängen, indem sie die Proteine der jeweils anderen Gruppe phosphorylieren. Die losgelösten Proteine werden dann im Zellinneren, dem Cytosol, wieder dephosphoryliert und können dann erneut binden. Diese Verzögerung des erneuten Membranbindens nach Loslösen ist entscheidend für die korrekte Ausrichtung des Proteinmusters entlang der langen Zellachse.
An den Polen treffen Proteine aufgrund der Zellgeometrie häufiger auf die Membran auf. Je nachdem, ob die Proteine länger in einem phosphorylierten Zustand bleiben oder nicht, gewinnt dort schnell eine Proteinsorte die Überhand: „Die Loslösung von der Membran geschieht proportional dazu, wie viele Proteine einer Sorte bereits auf der Membran sind. Sobald eine Proteinsorte auf der Membran am Pol die Oberhand gewonnen hat, bildet sich dort eine stabile Domäne aus, und die andere Proteinsorte hat keine Chance mehr“, sagt Geßele.
Zusätzliche Unterstützung bekommt die Musterbildung entlang der langen Achse des ellipsoiden Embryos dadurch, dass der Übergangsbereich zwischen der aPAR- und der pPAR-Domäne, in dem sich beide Proteingruppen auf der Membran fortwährend gegenseitig stören, von der Zelle aus energetischen Gründen möglichst klein gehalten wird. Dies ist dann der Fall, wenn die beiden Domänen jeweils einen Zellpol einnehmen und damit der Übergangsbereich zwischen den Domänen minimiert wird. „Die Polarisation von Zellen spielt in vielen biologischen Systemen eine entscheidende Rolle“, sagt Frey. „Unsere Ergebnisse ermöglichen neue Einsichten in die Mechanismen, mit denen die Zelle diese grundlegenden Prozesse reguliert.“
LMU / DE













