Mechanismus für die Ausbreitung von Signalen über Moleküle hinweg entdeckt
„Allosterischen Hebel“ erklärt, wie strukturelle Veränderungen über große Entfernungen hinweg gezielt zwischen Proteinen übertragen werden – Anwendungen in Wirkstoffforschung und synthetischer Biologie.
Allosterie ist der Prozess, bei dem eine Veränderung an einer Stelle eines Moleküls, beispielsweise die Bindung eines Liganden, die Aktivität an einer weit entfernten Stelle beeinflusst. So steuert dieser Mechanismus die Funktion von Proteinen und Nukleinsäuren. Ein Beispiel ist das sauerstofftransportierende Protein Hämoglobin im Blut: Wenn sich ein Sauerstoffmolekül daran bindet, verändert das gesamte Protein seine Form, wodurch sich weitere Sauerstoffmoleküle leichter binden können.
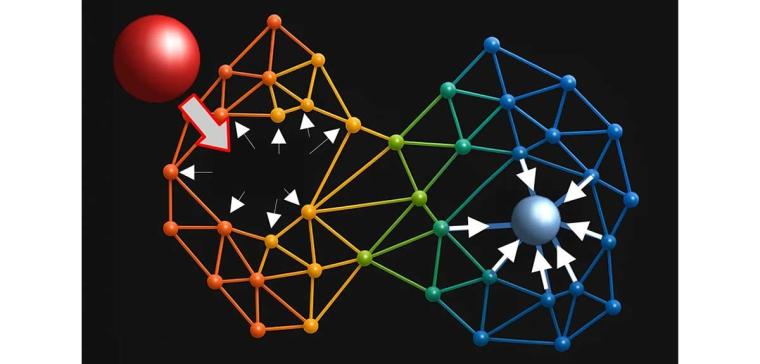
Trotz ihrer zentralen Rolle in der Biologie ist die physikalische Grundlage der Allosterie bislang ungeklärt. Weder typische Strukturmotive noch charakteristische dynamische Verhaltensweisen oder einfache thermodynamische Prinzipien konnten das Phänomen ausreichend erklären. Stattdessen scheint sie komplexe, koordinierte Bewegungen zu erfordern, die in hohem Maße von der Molekülstruktur abhängen. Maximilian Vossel, Bert de Groot und Aljaz Godec vom MPI für Multidisziplinäre Naturwissenschaften haben nun einen spezifischen Mechanismus identifiziert, den sie als „allosterischen Hebel“ bezeichnen. Dieser erklärt, wie strukturelle Veränderungen über große Entfernungen hinweg auf Proteine übertragen werden.
Die Forschenden untersuchten diesen Mechanismus anhand elastischer Netzwerkmodelle von Proteinen. Dabei handelt es sich um vereinfachte Darstellungen, in denen Proteine als Netzwerke aus Federn modelliert werden, die ihre Aminosäuren verbinden. Mithilfe dieser Modelle entwickelten das Team eine Methode, um zu analysieren, wie Proteinstrukturen nichtlinear auf generische mechanische Störungen reagieren, wie beispielsweise die Bindung eines Ligandenmoleküls. Sie fanden heraus, dass Störungen an Schlüsselstellen in Proteinen mit allosterischer Aktivität eine spezifische Kopplung veranlassen: Steife, lokalisierte Bewegungen sind mechanisch mit breiteren, weicheren Verformungen an anderen Stellen der Struktur verbunden. Störungen an nicht-allosterischen Stellen führen dagegen zu gleichmäßigeren und weniger gerichteten mechanischen Reaktionen. Dieser Kopplungsmechanismus erklärt, wie minimale Veränderungen an einer Stelle eines Proteins spezifische funktionelle Effekte an entfernten Stellen auslösen können. Interessanterweise sind die Aminosäuresequenzen, die für die Übertragung dieser Veränderungen verantwortlich sind, evolutionär konserviert – sie kommen also in vielen Organismen in nahezu unveränderter Form vor.
Die Ergebnisse bestätigen die Hypothese, dass Allosterie eine grundlegende Eigenschaft von Proteinstrukturen ist, die in bestimmten Fällen selektiv verstärkt wird. Diese Reaktion ist nichtlinear, gerichtet und tritt nur auf, wenn das Molekül aktiv gestört wird, beispielsweise durch die Bindung eines anderen Moleküls. Damit ist Allosterie ein grundlegend nicht im Gleichgewicht befindliches Phänomen – also ein dynamischer Prozess, der sich nicht allein durch Gleichgewicht erklärt lässt. Die neuen Erkenntnisse könnten für die Entwicklung neuer Biomoleküle mit modulierten allosterischen Eigenschaften sowie für die Wirkstoffforschung und die synthetische Biologie von Nutzen sein. [MPINAT / dre]
Weitere Informationen
- M. Vossel, B. L. de Groot, & Aljaž Godec, Allosteric Lever: Toward a Principle of Specific Allosteric Response, Phys. Rev. X 15, 021097, 20. Juni 2025; DOI: 10.1103/wv2k-676p
- Forschungsgruppe Mathematische Biophysik (Aljaž Godec), Max-Planck-Institut für Multidisziplinäre Naturwissenschaften, Göttingen
- Forschungsgruppe Computergestützte Biomolekulare Dynamik (Bert de Groot), Max-Planck-Institut für Multidisziplinäre Naturwissenschaften, Göttingen