Wie ein Supermikroskop Nanofabriken in Aktion einfangen soll
Kryo-TEM macht kurzlebige Zwischenzustände von Ribosomen im Millisekundenbereich sichtbar.
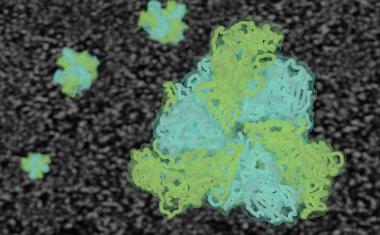
Ribosomen sind die Miniatur-Fabriken des Lebens. Wer ihre mechanische Meisterleistung im Detail versteht, liefert die Wissensgrundlage für vielfältigste Anwendungen – von der Impfstoffherstellung bis zur Entwicklung neuer Antibiotika. Christian Spahn, Biophysiker an der Charité – Universitätsmedizin Berlin, will die Nanofabriken deshalb in Aktion sehen. Und scheut keinen Aufwand: Mit ultrakalten Temperaturen und einem vier Meter hohen Mikroskop, das gelagert werden muss wie ein rohes Ei, möchte er Ribosomen in bisher unerreichter zeitlicher Auflösung ablichten.

Jede lebende Zelle braucht Ribosomen. Die nur 25 Nanometer großen Fabriken entziffern den genetischen Code und produzieren nach seiner Anleitung Proteine, die als Strukturelemente, Botenstoffe oder andere molekulare Werkzeuge in der Zelle benötigt werden. Wie am Fließband setzen Ribosomen rund um die Uhr in rasendem Tempo hunderte Bauteile zu Protein-Produkten zusammen. „Bisher konnten wir nur Momentaufnahmen dieses äußerst komplexen Vorgangs einfangen“, erklärt Spahn. „Jetzt wollen wir genauer hinschauen und die ultraschnellen Zwischenschritte sichtbar machen.“
Zusammen mit seinem Team will Spahn entschlüsseln, wie exakt die Ribosomen bei ihrer Arbeit ihre Form verändern und wie Temperatur, Ionen oder Antibiotika die Vorgänge beeinflussen. Das ist einfacher gesagt als getan – und braucht hochmoderne Technik. Eine ganze Reihe wissenschaftlicher Institutionen Berlins haben Jahre darauf hingearbeitet, die nötige technische Infrastruktur aufzubauen.
Für eine Aufnahme aktiv produzierender Ribosomen muss das Team die Ribosomen zunächst aus der Zelle herauslösen und außerhalb ihrer angestammten Umgebung zum Arbeiten anregen. Dazu haben die Forscher eigens eine neue Methode entwickelt. Dann kommt die Eiseskälte: Die Proben werden in flüssigem Ethan bei minus 150 Grad Celsius schockgefroren, damit sich keine Eiskristalle bilden, sondern glasklares Eis die Moleküle in ihrer natürlichen Form umschließt. Hauchdünne Scheibchen der Probe – nur dreihundert Nanometer dick – werden schließlich unter ein Hochleistungsmikroskop gelegt, das es in sich hat: das Kryo-Transmissions-Elektronenmikroskop, kurz Kryo-TEM.
Das Besondere an dem fünf Millionen Euro teuren Gerät: Es ist in der Lage, winzigste Zellstrukturen in ihrer natürlichen wässrigen Umgebung dreidimensional sichtbar zu machen – und zwar in fast atomarer Auflösung, also im Bereich von weniger als einem Millionstel Millimeter. Frühere Elektronenmikroskope machten eine chemische Präparation der Proben nötig, gaben also nicht unbedingt die ursprüngliche Struktur der Moleküle wieder. Für die Entwicklung der Kryo-Elektronenmikroskopie, bei der die Proben chemisch nicht verändert werden, ist 2017 der Chemie-Nobelpreis verliehen worden. Einer der Preisträger war Joachim Frank, bei dem Christian Spahn die Feinheiten der Bildgebungsmethode gelernt hat.
Die im Kryo-TEM verbaute Technik nimmt nicht nur viel Raum ein – das Mikroskop misst ganze vier Meter – sondern ist auch hochsensibel: Sie verträgt weder Temperaturschwankungen noch zu hohe Luftfeuchtigkeit oder Vibrationen. Das ist der Grund, warum das Kryo-TEM ein eigenes Gebäude bekommen hat. Wie ein „Haus im Haus“ doppelwandig gebaut, mit einem 1,25 Meter dicken Betonboden, der Schwingungen ausgleicht, und einer effizienten Lüftungsanlage.
Das Mikroskop selbst liefert allerdings nur ziemlich verrauscht wirkende Einzelbilder. Damit ein 3D-Modell des Ribosoms entsteht, braucht es im letzten Schritt eine moderne digitale Bildverarbeitung – und Rechenpower. „Wir analysieren Hunderttausende Bilder mithilfe moderner Computerverfahren, um sie automatisch zu sortieren und zu klassifizieren“, erläutert Spahn. „Die Berechnungen dauern Wochen bis Monate. So können wir auch sehr seltene, kurzlebige Zwischenzustände der Ribosomen im Millisekundenbereich sichtbar machen, die bisher im Verborgenen geblieben sind.“
Der Aufwand lohnt sich: Ein besseres mechanisches Verständnis der Protein-Fabriken klärt nicht nur ein fundamentales Prinzip des Lebens auf, sondern hat potenziell auch Relevanz für Biotechnologie oder Medizin. „Die Erkenntnisse könnten genutzt werden, um die künstliche Proteinherstellung zu optimieren – beispielsweise zur Produktion von Medikamenten, Impfstoffen oder künstlichen Zellen“, sagt Spahn. „Weil Ribosomen der Hauptangriffspunkt für Antibiotika sind, kann ein besseres Verständnis ihrer Funktionsweise außerdem helfen, wirksamere Medikamente gegen resistente Bakterien zu entwickeln.“
Charité / RK