Gehirnaktivität formen – ein mechanischer Prozess?
Internationales Forschungsteam liefert neue Erkenntnisse über neurologische Entwicklungsstörungen.
Beim Denken vollbringt das menschliche Gehirn wahre Meisterleistungen in der Informationsverarbeitung: Etwa 100 Milliarden Nervenzellen kommunizieren dabei über rund 100 Billionen Knotenpunkte miteinander. Ein internationales Forscherteam unter Beteiligung des Max-Planck-Zentrums für Physik und Medizin hat herausgefunden, dass bei der Entwicklung dieser Verschaltungen und der Entstehung elektrischer Signale mechanische Eigenschaften des Gehirns eine wichtige Rolle spielen. Die Erkenntnisse könnten neue Ansätze für das Verständnis neurologischer Entwicklungsstörungen eröffnen.
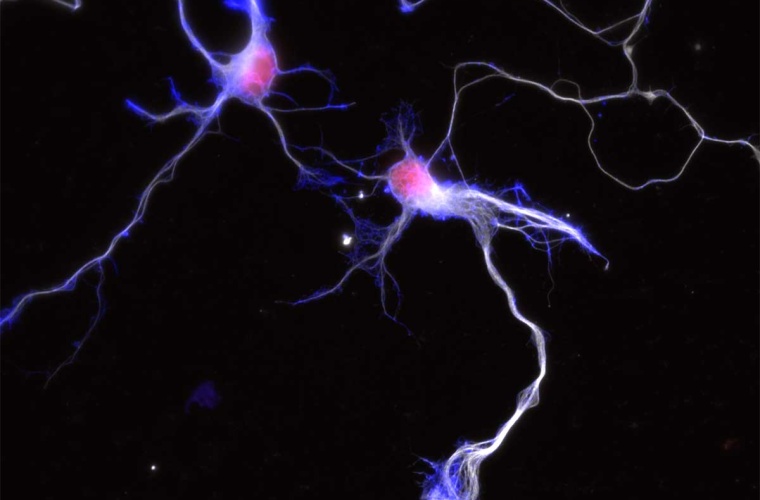
Im Gehirn verbinden hochspezifische Kontakte, die Synapsen, Nervenzellen miteinander und leiten elektrische Signale zielgerichtet weiter. Wie sich die Synapsen während der Gehirnentwicklung ausbilden, ist trotz jahrzehntelanger Forschung immer noch nicht vollständig verstanden. Nun hat ein internationales Forschungsteam des MPZPM, der University of Cambridge und der University of Warwick herausgefunden, dass mechanische Eigenschaften des Gehirns eine bedeutende Rolle in diesem Entwicklungsprozess spielen. Die Wissenschaftler:innen konnten zeigen, wie die Fähigkeit von Neuronen, Steifigkeit wahrzunehmen, mit molekularen Mechanismen zusammenhängt, die die neuronale Entwicklung regulieren.
Während seiner Entwicklung hat das Gehirn eine sehr weiche Konsistenz, etwa vergleichbar mit der von Frischkäse. Je nach Region variiert jedoch seine Steifigkeit. Bei Embryonen des Afrikanischen Krallenfrosches (Xenopus laevis) stellten die Forschenden fest, dass weichere Gehirnareale eine höhere Anzahl an Synapsen haben als steifere Regionen. Um zu testen, ob die Steifigkeit einen direkten Einfluss auf die Synapsenbildung hat, versteifte das Team um Kristian Franze, Leiter der Abteilung Neuronale Mechanik am MPZPM, sowie Professor an der Friedrich-Alexander-Universität Erlangen-Nürnberg und University of Cambridge, das Gehirn künstlich und beobachtete, dass sich die Synapsenentwicklung in allen Regionen verzögerte. Die Forschenden bewiesen so, dass mechanische Eigenschaften des Gehirns aktiv beeinflussen, wie schnell und wo Synapsen gebildet werden. „Dies verändert unser Verständnis davon, wie das Gehirn reift, grundlegend“, sagt Franze. „Bislang hat sich die Neurowissenschaft vor allem darauf konzentriert, wie chemische Signale die Entwicklung des Gehirns beeinflussen. Die Berücksichtigung mechanischer Signale bietet eine neue Perspektive auf die Entwicklung des Gehirns und könnte zu neuen Erkenntnissen über neurologische Entwicklungsstörungen führen“, fügt Eva Kreysing, Assistenz-Professorin an der University of Warwick, hinzu.
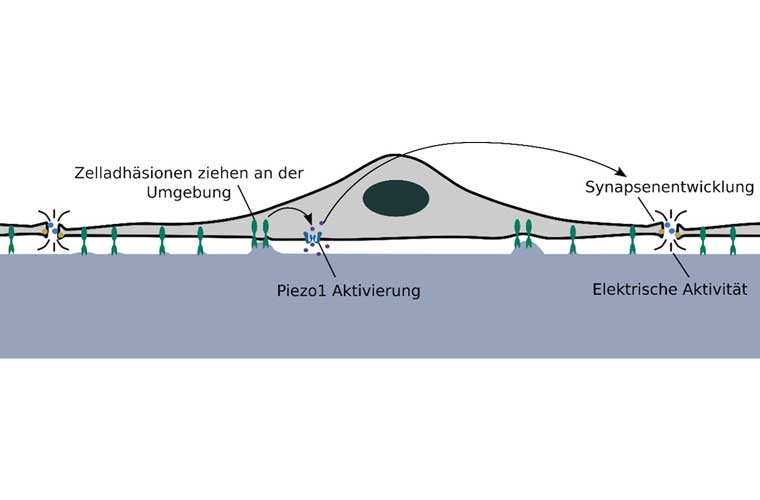
Um zu verstehen, wie Nervenzellen ihre mechanische Umgebung wahrnehmen, untersuchte das Team genetisch veränderte Neuronen. So konnten sie bestimmte Proteine in Neuronen eliminieren und Prozesse wie die Synapsenbildung und die elektrische Signalübertragung unter kontrollierten Bedingungen untersuchen. Die Forschenden fanden heraus, dass sowohl die Synapsenbildung als auch die elektrische Aktivität von der Steifigkeit der Umgebung abhängen. Neuronen nehmen diese Steifigkeit über den mechanosensitiven Ionenkanal Piezo1 wahr. Die Wissenschaftler:innen maßen dann die Expression Tausender Gene und entdeckten, dass Piezo1 die neuronale Entwicklung in steiferen Umgebungen verzögert, indem es die Expression von Transthyretin reduziert – einem Protein, von dem kürzlich gezeigt wurde, dass es die Synapsenbildung reguliert. Durch die Aufdeckung dieses Signalwegs konnte das Team aufzeigen, wie die Wahrnehmung von Steifigkeit mit molekularen Mechanismen zusammenhängt, die die neuronale Entwicklung steuern.
„Diese Ergebnisse unterstreichen die Bedeutung mechanischer Signale für die Gehirnentwicklung und weisen auf ihre mögliche Rolle bei der Entstehung von neuronalen Schaltkreisen im Gehirn hin“, schlussfolgert Thora Karadottir, Professorin an der University of Cambridge, die auch maßgeblich zum Projekt beigetragen hat. Die identifizierte Signalkaskade, die die steifigkeitsabhängige Entwicklung von Nervenzellen steuert, bietet Forschenden zukünftig neue Ansatzpunkte zur Erforschung entwicklungsbedingter Erkrankungen des Nervensystems, die beispielsweise zu Schizophrenie oder Autismus führen könnten. [MPZPM / dre]
Weitere Informationen
- Originalpublikation
E. Kreysing, H. O. B. Gautier, S., Mukherjee, et al., Environmental stiffness regulates neuronal maturation via Piezo1-mediated transthyretin activity, Nat. Commun. 16, 9842, 7. November 2025; DOI: 10.1038/s41467-025-64810-3 - Neuronale Mechanik (Abteilung Kristian Franze), Max-Planck-Zentrum für Physik und Medizin, Erlangen, und Direktor des Instituts für Medizinische Physik und Mikrogewebetechnik, Friedrich-Alexander Universität Erlangen-Nürnberg
- Eva Kreysing, Principal Investigator, Biomedical Sciences Directorate, Warwick Medical School, University of Warwick, Coventry
Anbieter
Max-Planck-Institut für die Physik des LichtsStaudtstr. 2
91058 Erlangen
Deutschland
Meist gelesen

Teleportation zwischen zwei Quantenpunkten gelungen
Quanten-Wifi: Polarisationszustand eines einzelnen Photons per Freiraumverbindung zwischen zwei Universitätsgebäuden auf ein anderes übertragen.

Warum wir wirklich auf Eis rutschen
James Thompson lag falsch: weder Druck noch Reibung haben einen großen Effekt auf die Bildung eines dünnen Flüssigkeitsfilms auf dem Eis

Planeten halten Sonne im Zaum
HZDR-Fluiddynamik-Team führt vergleichsweise geringe solare Aktivität auf eine Synchronisation durch die Gezeitenwirkung der Planeten zurück.

Bazinga! Physiker lösen ein Problem aus The Big Bang Theory
Fusionsreaktoren könnten dazu beitragen, Licht in aus exotischen Skalaren gebildete Dunkle Materie zu bringen.

Ausgestoßener Planet entdeckt und vermessen
Internationalem Team von Astronomen gelingt „Entdeckung des Jahrzehnts“.












