Zellen mit Licht in Form bringen
Wie ein optischer Reiz über chemische und mechanische Wechselwirkungen eine Formänderung der Zelle auslöst.
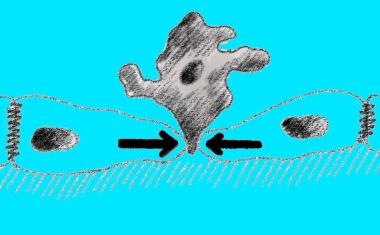
Eine wesentliche Eigenschaft aller lebenden Organismen ist, dass Zellen ihre Form dynamisch ändern können – ansonsten würden fundamentale Prozesse wie die Zellteilung nicht funktionieren. Einem internationalen Team um den Physiker Erwin Frey von der Uni München und Nikta Fakhri vom MIT ist es jetzt durch die Kombination experimenteller und theoretischer Methoden erstmals gelungen, die Mechanismen zu entschlüsseln, mit denen Zellen ihre Form als Reaktion auf Umwelteinflüsse dynamisch verändern – und diesen Prozess von außen zu steuern.
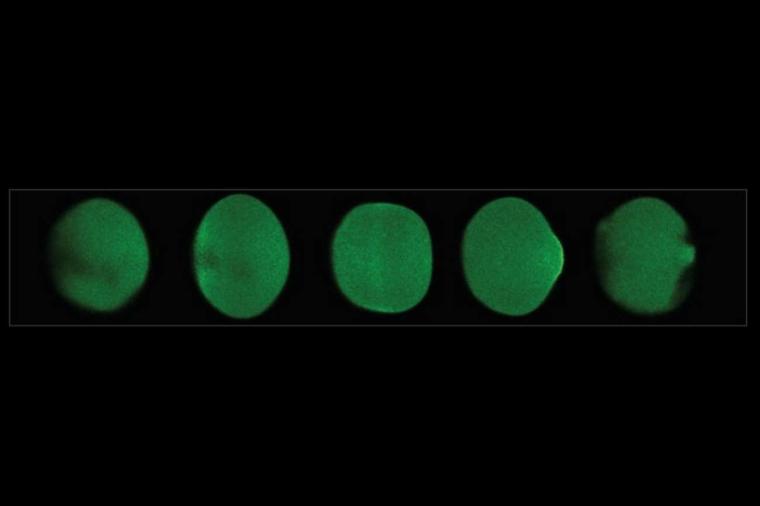
Frühere Studien hatten bereits gezeigt, dass bei der Festlegung der Zellform die Bildung biologischer Muster durch sich selbst organisierende Proteine eine entscheidende Rolle spielt. Die Forscher untersuchten dieses komplexe Netzwerk am Beispiel der Eizellen des Seesterns Patiria miniata, die während ihrer Teilung eine charakteristische Formänderung durchlaufen. Getrieben wird diese Formänderung von zwei Enzymen: Der kleinen GTPase Rho und ihrem Aktivierungsenzym GEF. Indem sie einen mit Licht steuerbaren molekularen Schalter in GEF einbauten, gelang es den Forschern, die Formänderungen der Eizellen gezielt optogenetisch zu beeinflussen.
„Mit diesen Schalter konnten wir die Proteinverteilung in der Zelle durch Lichtreize beliebig modulieren, was zu Verformungen führte“, sagt Tom Burkart von der Uni München. „So haben wir eine große Bandbreite an Varianten erzeugt – von lokalen Eindellungen bis hin zu einer eindrücklichen Verformung zu einer quadratischen Zelle.“
Anschließend entwickelten die Wissenschaftler ein theoretisches Modell, das beschreibt, wie der optische Reiz über chemische und mechanische Wechselwirkungen eine Formänderung der Zelle auslöst. Dabei identifizierten sie zwei zentrale Mechanismen: einerseits „geführte Deformationen“, bei denen Formveränderungen lokal begrenzt bleiben, andererseits „ungeführte Deformationen“, die sich durch Selbstorganisation in der gesamten Zelle ausbreiten.
„Unsere Ergebnisse zeigen, dass lebende Zellen deutlich vielseitiger sind als bisher angenommen“, sagt Frey. „Diese Erkenntnisse könnten weitreichende Implikationen für die Entwicklung synthetischer Zellen und biomimetischer Materialien haben und neue Möglichkeiten für synthetische Biologie und zellbasierte Technologien eröffnen.“
LMU / RK
Weitere Infos
- Originalveröffentlichung
J. Liu et al.: Light-induced cortical excitability reveals programmable shape dynamics in starfish oocytes, Nat. Physics, online 24. März 2025; DOI: 10.1038/s41567-025-02807-x - Statistische und biologische Physik (E. Frey), Arnold Sommerfeld Center for Theoretical Physics and Center for Nano Science, Ludwig-Maximilians-Universität München
- Fakhri Lab, Physics of Living and Non-Equilibrium Systems, Dept. of Physics, Massachusetts Institute of Technology, Cambridge, USA