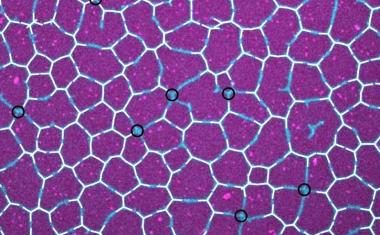
Theorie zur Musterbildung von Protein-Grenzflächen
LMU-Biophysiker haben ein Modell entwickelt, wie Reaktions-Diffusions-Netzwerke „Schäume“ bilden können.

LMU-Biophysiker haben ein Modell entwickelt, wie Reaktions-Diffusions-Netzwerke „Schäume“ bilden können.

Ein in München entwickeltes Modell zeigt, wie biologische Prozesse die verschlungene interne Architektur des Thymus formen – und so Autoimmunreaktionen besser unterdrücken können.
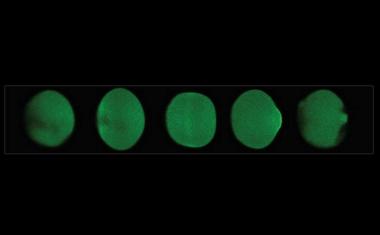
Wie ein optischer Reiz über chemische und mechanische Wechselwirkungen eine Formänderung der Zelle auslöst.

Theoretisches Modell basiert auf grundlegenden Prinzipien der Selbstorganisation.

Form von Komponenten ist wesentlich, wie schnell und effizient sich komplexe Strukturen selbst zusammenbauen.

Am Sonntag startet in Berlin die größte der fünf diesjährigen Frühjahrstagungen der DPG.

Die DPG-Preisträgerinnen und -Preisträger für das Jahr 2024 stehen fest.

Münchener Biophysiker konstruieren ein neues zellähnliches Transportsystem.

Flüssigkeitsströmungen haben spürbaren Einfluss auf zelluläre Proteinmuster.
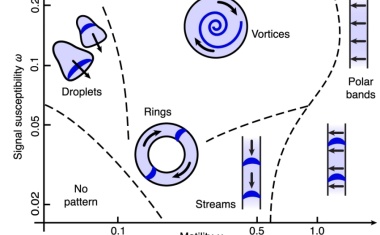
Modell beschreibt komplexe Strukturbildung durch Selbstorganisation.

Neue Theorie ermöglicht die Simulation komplexer Musterbildung in biologischen Systemen über unterschiedliche räumliche und zeitliche Skalen.
Neue Strategie für die effiziente Fertigung nanoskaliger Objekte.
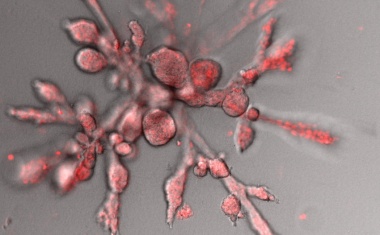
Biophysiker erklären komplexe Strukturbildung in Mini-Organen.

Logistik per Diffusiophorese erstmals in biologischem Musterbildungssystem nachgewiesen.
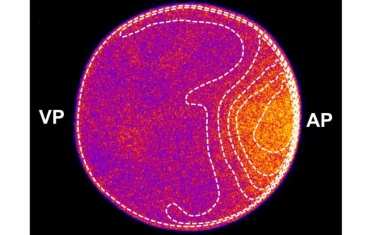
Robuste Proteinmuster entstehen durch zellinterne Konzentrationsgefälle.
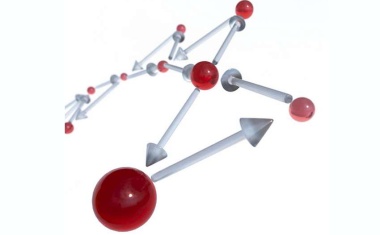
Topologische Effekte schlagen eine Brücke von der Festkörperphysik zur Biophysik.
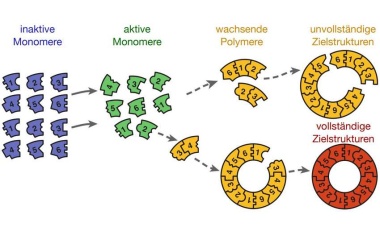
Der Zufall als Störfaktor bei der Selbstmontage von Biomolekülen
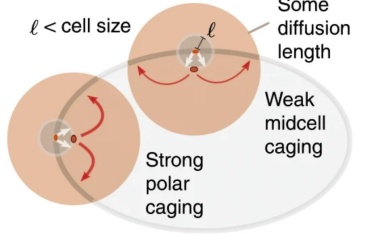
Geometrische Musterbildung spielt entscheidende Rolle für erste Zellteilung.
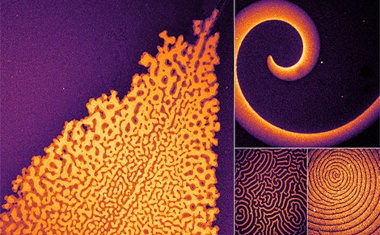
Physikalisches Modell für die Erklärung einer Musterbildung in Bakterienkulturen.

Wachstumsdynamik von Zellverbänden in Mikroräumen untersucht.
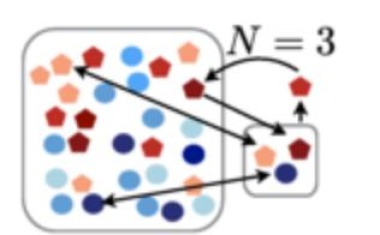
Statistische Analyse belegt evolutionären Vorteil durch verzögerte Anpassung.

Konformationsänderung spielt wichtige Rolle bei Steuerung der Zellteilung.

Frei diffundierende Proteine schneller unterwegs als mit Motorproteinen, wenn diese in Stau geraten.

Neues Modell beschreibt Mechanismen bei der Umstrukturierung von Mikrotubuli.

Selbstorganisation führt zur Bildung rotierender Ringe.

Auch gleich große Teilchen sortieren von selbst – wenn sie sich unterschiedlich bewegen.

Computersimulationen zeigen, wie sich Proteinmuster in Bakterienzellen bilden.
Bakterien in Flüssigkeiten zeigen komplexe Bewegungsmuster, die neue Mathematik erfordern.

Selbstorganisation bei Aktin-Filamenten weist auf neue Möglichkeiten zur Kontrolle von Nanosystemen.

Spieletheorie liefert Hinweise, warum diese Quantenteilchen sich so gern in Gruppen zusammenfinden.

Anwendung auf aktiv angetriebene Teilchensysteme zeigt bislang unbekannte Muster kollektiver Teilchenbewegung.

Biophysikalisches Modell erklärt die Dynamik von Ja-Nein-Regeln.

Im November waren über 100.000 Wissenschaftlerinnen und Wissenschaftler aufgerufen, die DFG-Fachkollegien zu wählen.

Biologisches Modellsystem mit „absorbierendem Zustand“ bildet Sackgasse für Energie.

Biophysiker entwickeln Modell zur Beschreibung der Dynamik von molekularen Motoren.

Ein neues biophysikalisches Modellsystem untersucht das Gruppenverhalten von Nanomaschinen.

Spezifische Form des DNA-Moleküls im Organismus ist die Folge eines Wechselspiels mehrerer physikalischer Kräfte.

Eine Kombination aus statistischer Physik und Simulationen mit rastertunnelmikroskopischen Aufnahmen soll die molekulare Selbstorganisation optimieren.
Einzeller geben neue Aufschlüsse über die Entwicklung der Arten und ihrer Vielfalt.

Dünne Nanofasern in paradoxer Zickzack-Bewegung.
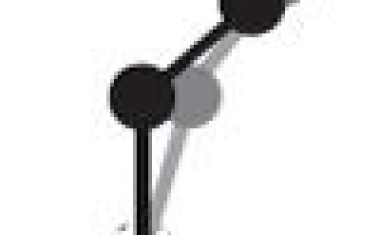
Molekulare Motoren arbeiten mit winzigen Scharnieren und Hebelarmen. Ein theoretisches Modell zeigt nun, dass die Biegsamkeit dieser Strukturen ein entscheidender Faktor für deren Funktionsweise ist.

Theoretische Physiker aus München beschreiben mit der evolutionären Spieltheorie, welch entscheidende Rolle die Mobilität von Arten in Ökosystemen spielt.

Münchner Physiker konnte erstmals die mechanischen Eigenschaften von Faserbündeln im Skelett einer biologischen Zelle näher bestimmen.

Die Transporteigenschaften in biologischen Zellen und anderen ungeordneten Materialien lassen sich direkt von der geometrischen Struktur ableiten.